
| ||
 ,
, ;
;| 63.2g |
| 158g/mol |
| 0.4mol |
| 2 |


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
| c(H2SO3) |
| c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/K | 303 | 313 | 323 |
| 平衡时NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
6 3 |
14 7 |
23 11 |
7 3 |
14 6 |
24 12 |
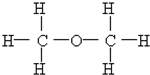 ⑩
⑩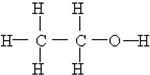 (11)
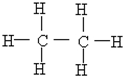
(11)
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 80 | 160 | 240 | 320 |
| c(NO2)/mol?L-1 | 0.0540 | 0.0420 | 0.0340 | 0.0300 | 0.0300 |
| c(N2O4)/mol?L-1 | 0 | 0.0060 | 0.0100 | 0.0120 | 0.0120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com