
【题目】常温下,分别向NaX溶液和YCl溶液中加入盐酸和氢氧化钠溶液,混合溶液的pH与离子浓度变化关系如图所示,下列说法不正确的是

A.L1表示![]() 与pH的变化关系
与pH的变化关系
B.Kb(YOH)=10-10.5
C.a点时两溶液中水的电离程度不相同
D.0.1mol·L-1的YX溶液中离子浓度关系为:c(Y+)>c(X-)>c(OH-)>c(H+)
【答案】D
【解析】
NaX的Kh=![]() ,则
,则![]() =
=![]() ,所以-lg
,所以-lg![]() =-lg
=-lg![]() =-lg
=-lg![]() +lgKh=14-pH+lgKh;同理YCl的Kh′=
+lgKh=14-pH+lgKh;同理YCl的Kh′=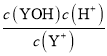 ,则
,则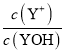 =
=![]() ,-lg
,-lg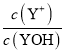 =pH+lgKh′。
=pH+lgKh′。
A.根据以上分析知,-lg![]() =14-pH+lgKh,-lg
=14-pH+lgKh,-lg![]() 越大,溶液的pH值越小;-lg
越大,溶液的pH值越小;-lg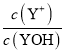 =pH+lgKh′,-lg
=pH+lgKh′,-lg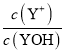 越大,溶液的pH值越大,所以L1表示-lg
越大,溶液的pH值越大,所以L1表示-lg![]() 与pH的变化关系,L2表示-lg
与pH的变化关系,L2表示-lg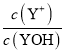 与pH的变化关系,故A正确;
与pH的变化关系,故A正确;
B.当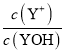 =1时,Kb(YOH)=
=1时,Kb(YOH)=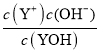 =c(OH-)=
=c(OH-)=![]() =10-10.5,故B正确;
=10-10.5,故B正确;
C.a点溶液呈酸性,NaX溶液含有的HX电离导致溶液呈酸性,YCl溶液中阳离子水解导致溶液呈酸性,所以对于NaX溶液是抑制水电离、对于YCl溶液是促进水电离,故C正确;
D.a点溶液的pH及纵坐标相等,则14-pH+lgKh=pH+lgKh′,根据图知,14-2pH=lgKh′-lgKh>0,说明水解程度YCl>NaX,所以在YX溶液中水解程度Y+>X-,溶液呈酸性,结合电荷守恒得c(X-)>c(Y+)>c(H+)>c(OH-),故D错误;
故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】阿莫西林是一种最常用的半合成青霉素类广谱β-内酰胺类抗生素,某研究小组按下列路 线合成:
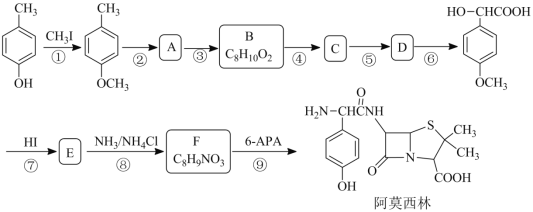
已知:
![]()
请回答:
(1)B 的结构简式为_____。
(2)下列说法正确的是_____。
A 化合物 B 的官能团是醛基 B 反应①的目的是为了保护酚羟基
C 化合物 D 能发生消去反应 D 阿莫西林的分子式是 C16H19N3O5S
(3)写出第⑨步反应的化学反应方程式_____。
(4)设计以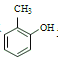 为原料制备水杨酸(
为原料制备水杨酸(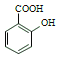 )的合成路线 (用流程图表示,无机试剂任选)_____。
)的合成路线 (用流程图表示,无机试剂任选)_____。
(5)写出同时符合下列条件的 F 的所有同分异构体的结构简式_____。
①分子中有苯环且是苯环的对位二取代物
②分子中含有硝基且不与苯环直接相连
③分子不与金属钠反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叶蝉散(isoprocard)对水稻叶蝉和飞虱具有较强的触杀作用,防效迅速,但残效不长.工业上用邻异丙基苯酚合成叶蝉散的过程如下:

下列有关说法正确的是( )
A.叶蝉散的分子式是C11H16NO2
B.邻异丙基苯酚发生了取代反应
C.叶蝉散在强酸、强碱性环境中能稳定存在
D.可用FeCl3检验叶蝉散中是否含邻异丙基苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、Cu2O 广泛应用于太阳能电池领域。以 CuSO4、NaOH 和抗坏血酸为原料,可制备 Cu2O。
(1)Cu2+基态核外电子排布式为________。
(2)SO4 2﹣的空间构型为_________(用文字描述),Cu2+与 OH-反应能生成[Cu(OH)4 ]2-, [Cu(OH)4]2-中的配位原子为_______(填元素符号)。
(3)抗坏血酸的分子结构如图 1 所示,分子中碳原子的轨道杂化类型为________;推测抗坏血酸在水中的溶解性:_______(填“难溶于水”或“易溶于水”)。
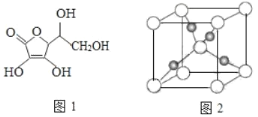
(4)一个 Cu2O 晶胞(如图 2)中,Cu 原子的数目为_________。
Ⅱ、磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用 FeCl3、NH4H2PO4、LiCl 和苯胺等作为原料制备。回答下列问题:
(5)在周期表中,与 Li 的化学性质最相似的邻族元素是___,该元素基态原子核外 M层电子的自旋状态_______(填“相同”或“相反”)。
(6)苯胺(![]() )的晶体类型是_________。苯胺与甲苯(
)的晶体类型是_________。苯胺与甲苯( ![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
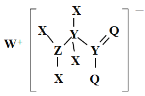
A.Z的最高价氧化物对应的水化物是一元强酸
B.WX的水溶液呈中性
C.元素非金属性的顺序为Y>Z>Q
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡均属于溶液中的离子平衡。根据要求回答问題。
(1)常温下0.1mol·L-1的HA溶液中pH=3,则HA是______(填“强电解质”或“弱电解质”),其电离方程式____________________________________。
(2)已知:常温下0.1mol·L-1 BOH溶液pH=13,将V1L0.1mol·L-1HA溶液和V2L 0.1 mol·L-1BOH溶液混合,回答下列问题:
①当V1:V2=1:1时,溶液呈____性,请用离子方程式解释原因________________。
②当混合溶液pH=7时,溶液中离子浓度大小关系是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是

A. 正极电极反应式为:2H++2e—→H2↑
B. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C. 此过程中铜并不被腐蚀
D. 此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
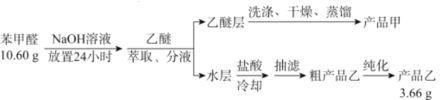
【题目】苯甲酸(![]() )是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(
)是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(![]() )的实验流程:
)的实验流程:
已知:① ;
;![]() ;
; (R、R1表示烃基或氢原子)
(R、R1表示烃基或氢原子)
②相关物质的部分物理性质见表:
名称 | 相对密度 | 熔点/℃ | 沸点/℃ | 溶解度 | |
水 | 乙醚 | ||||
苯甲醛 | 1.04 | -26 | 179.6 | 微溶 | 易溶 |
苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
苯甲醇 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 |
乙醚 | 0.71 | -116.3 | 34.6 | 不溶 | — |
请回答下列问题:
(1)进行萃取、分液操作时所用玻璃仪器的名称为___________。分液时,乙醚层应从_______(填“下口放出”或“上口倒出”)。
(2)洗涤乙醚层时需要依次用NaHSO3溶液、10%Na2CO3溶液、蒸馏水进行洗涤。其中加入NaHSO3溶液洗涤的主要目的是________________,对应的化学方程式为___________________________。
(3)蒸馏获得产品甲时加入碎瓷片的目的为_____________,蒸馏时应控制温度在____℃左右。
A.34.6 B.179.6 C.205.7 D.249
(4)提纯粗产品乙获得产品乙的纯化方法名称为________________。
(5)称取10.60g的苯甲醛进行实验,最终制取产品乙的质量为3.66g,则产品乙的产率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关
B. H2O的熔、沸点高于H2S是由于H2O分子间存在氢键
C. 甲烷可与水形成氢键
D. 白酒中,乙醇分子和水分子间存在范德华力和氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com