
【题目】苯甲酸(![]() )是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(
)是重要的化工原料,可应用于消毒防腐、染料载体、增塑剂、香料及食品防腐剂的生产,也可用于钢铁设备的防锈剂。某化学实验小组在实验室中以苯甲醛为原料制取苯甲酸和副产品苯甲醇(![]() )的实验流程:
)的实验流程:
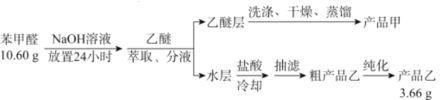
已知:① ;
;![]() ;
; (R、R1表示烃基或氢原子)
(R、R1表示烃基或氢原子)
②相关物质的部分物理性质见表:
名称 | 相对密度 | 熔点/℃ | 沸点/℃ | 溶解度 | |
水 | 乙醚 | ||||
苯甲醛 | 1.04 | -26 | 179.6 | 微溶 | 易溶 |
苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
苯甲醇 | 1.04 | -15.3 | 205.7 | 微溶 | 易溶 |
乙醚 | 0.71 | -116.3 | 34.6 | 不溶 | — |
请回答下列问题:
(1)进行萃取、分液操作时所用玻璃仪器的名称为___________。分液时,乙醚层应从_______(填“下口放出”或“上口倒出”)。
(2)洗涤乙醚层时需要依次用NaHSO3溶液、10%Na2CO3溶液、蒸馏水进行洗涤。其中加入NaHSO3溶液洗涤的主要目的是________________,对应的化学方程式为___________________________。
(3)蒸馏获得产品甲时加入碎瓷片的目的为_____________,蒸馏时应控制温度在____℃左右。
A.34.6 B.179.6 C.205.7 D.249
(4)提纯粗产品乙获得产品乙的纯化方法名称为________________。
(5)称取10.60g的苯甲醛进行实验,最终制取产品乙的质量为3.66g,则产品乙的产率为____________。
【答案】分液漏斗、烧杯 上口倒出 除去乙醚层中含有的苯甲醛 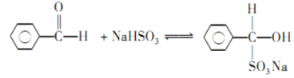 防止暴沸 D 重结晶 60%
防止暴沸 D 重结晶 60%
【解析】
(1)根据仪器名称写出相应的仪器名称;分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出;
(2)饱和亚硫酸氢钠溶液洗涤目的是洗去乙醚层中含有的苯甲醛;
(3)根据碎瓷片的作用及苯甲酸沸点分析;
(4)重结晶是将晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程;
(5)根据产率=![]() 进行计算。
进行计算。
(1)萃取分液用到的玻璃实验仪器名称是分液漏斗、烧杯;乙醚密度小于水,在上层,分液时,乙醚层应从上口倒出;
(2)醛类可以跟亚硫酸氢钠饱和溶液发生加成反应,实验步骤中的饱和亚硫酸氢钠溶液洗涤目的是洗去乙醚层中含有的苯甲醛,饱和碳酸钠溶液除去残留的亚硫酸氢钠;根据题给信息可知,二者发生加成反应,化学方程式为: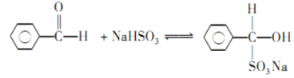 ;
;
(3)蒸馏获得产品甲时加入碎瓷片的目的为防止暴沸,蒸馏时得到产品甲为苯甲酸,应控制温度在249℃左右;
答案选D;
(4)提纯粗产品乙获得产品乙的纯化方法名称为重结晶;
(5)称取10.60g的苯甲醛进行实验,理论上得到苯甲酸的质量为![]() ,最终制取产品乙的质量为3.66g,则产品乙的产率为
,最终制取产品乙的质量为3.66g,则产品乙的产率为![]() 。
。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

(1)反应开始到10s,用Z表示的反应速率___________________
(2)反应开始到10s时,Y的转化率为__________________
(3)反应的化学方程式为:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向NaX溶液和YCl溶液中加入盐酸和氢氧化钠溶液,混合溶液的pH与离子浓度变化关系如图所示,下列说法不正确的是

A.L1表示![]() 与pH的变化关系
与pH的变化关系
B.Kb(YOH)=10-10.5
C.a点时两溶液中水的电离程度不相同
D.0.1mol·L-1的YX溶液中离子浓度关系为:c(Y+)>c(X-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH(OH)CH2CH![]() CH3CH=CHCH3+H2O,下列有关说法正确的是
CH3CH=CHCH3+H2O,下列有关说法正确的是
A.CH3CH=CHCH3分子中所有碳原子不可能处于同一平面
B.CH3CH=CHCH3和HBr加成产物的同分异构体有4种(不考虑立体异构)
C.CH3CH(OH)CH2CH3与乙二醇、丙三醇互为同系物
D.CH3CH(OH)CH2CH3、CH3CH=CHCH3均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
则反应IV:CO2(g)+H2(g)![]() HCOOH(g)的△H =____________kJmol-1。
HCOOH(g)的△H =____________kJmol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→MHCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[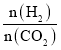 ]的变化如图所示:
]的变化如图所示:
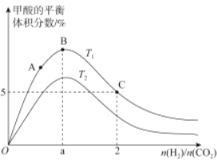
①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计SO2实验方案,做以下化学实验。
Ⅰ.实验方案一
(1)将SO2通入水中形成“SO2-饱和H2SO3溶液”体系,此体系中存在多个含硫元素的平衡,写出其中1个平衡方程式:________________________________________。
(2)已知:葡萄酒中有少量SO2可以做抗氧化剂[我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25 g·L-1]。
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图1的实验:
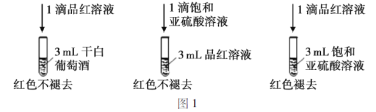
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_____________。
Ⅱ.实验方案二
如图2是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
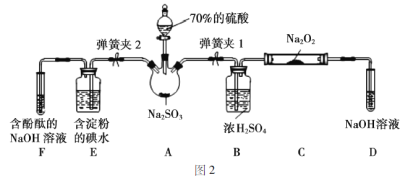
(1)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是_________________________。
(2)装置D中盛放NaOH溶液的作用是______________________。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为_____________;发生反应的离子方程式是______________。
Ⅲ.实验方案三
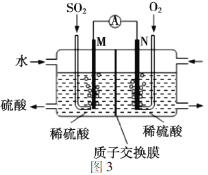
用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入图3装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能。M极发生的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料。
(1)氯气和石灰乳反应可以制得漂白粉,当漂白粉暴露在空气中因吸收了空气中的CO2和H2O而可能部分变质,写出验证漂白粉已部分变质的实验方法:________。
(2)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空,a、b、c、d中重合部分代表物质间反应,且氯水足量。
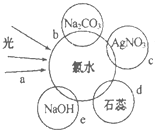
c过程的离子方程式为_______。
e过程中氧化还原反应的化学方程式为________。
d过程所观察到的现象为_______。
b过程证明了氯水中存在_________(填字母)微粒。
A Cl2 B Cl- C HClO DH+
(3)根据下表表弱酸的电离常数,写出二种可以增加饱和氯水中的次氯酸的浓度的钠盐_______。说明选择的理由或条件:_________。
某些弱酸的电离常数(298K) | ||
多元弱酸 | K1 | K2 |
HClO | 2.95×10-8 | |
CH3COOH | 1.76×10-5 | |
H2SO3 | 1.54×10-2 | 1.02×10-17 |
H2CO3 | 4.30×10-7 | 5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 1L水中溶解了40.0 g NaOH,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的NaCl液中取出0.5L,取出的该溶液的浓度为1mol/L
C. 中和100 mL 1mol/L的H2SO4溶液,需NaOH8.0g
D. 配制500mL0.5mol/L的CuSO4溶液,需40.0g胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与处理方法对应的反应方程式不正确的是
A.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
B.用高温催化氧化法去除烃类废气(CxHy):CxHy+(x+y/4)O2![]() xCO2+y/2H2O
xCO2+y/2H2O
C.用催化法处理汽车尾气中的CO和NO:CO+NO![]() C+NO2
C+NO2
D.用Na2S形成沉淀去除废水中的Hg2+:Hg2++S2-=HgS↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com