
����Ŀ�������������ĿǰΪֹ������ǿ���������ô�����Ԥ����δ��20������������������������Ĵ��Բ��ό��֡������������������Ҫԭ������ϡ�������ϡ��������������Լ�����ϡ��ԭ�ϡ�
(1) ��(Nd)Ϊ60��Ԫ�أ������ڱ��е�______���ڣ���̬��ԭ�ӵ���Χ�����Ų�ʽΪ______
(2) ʵ����AlCl3��ʵ�ʴ�����ʽΪAl2Cl6������ӵ����ģ����ͼ��ʾ��

�� ��֪Al2Cl6������������������غϣ���Al2Cl6����_________����(���������������Ǽ�����)��������A1ԭ��ȡ______�ӻ���
�� Al2Cl6�����NaOH��Һ��Ӧ����Na[Al(OH)4]��[A1(OH)4]���д��ڵĻ�ѧ����_____ (��ѡ����ĸ)��
A.���Ӽ� B.���ۼ� C.������ D.��λ�� E.���
(3) BԪ�ؼ�����ͬ�������ڵ�����Ԫ�ص�һ��������С�����˳��Ϊ______(��Ԫ�ط��ű�ʾ)��BԪ�ؿ���һ������������H3O+ [B(OH)F3]�� ���û������е縺������Ԫ�ص�ԭ���У������ܲ���ӵĵ���������ͼ��״��______��
(4) ������к��д������Ϻ�����������ʴ������һ�����㡣�ɵ����(Ni)��п(Zn)�Ƚ��б���Ϳ�㴦������֪Ni�����γ�[Ni(NH3)6]Cl2�����������������ӵĿռ乹��Ϊ _______ ��
(5) ��֪����BN����Ӳ���࣬�侧���ṹ��ͼ��ʾ���辧���������B��Nԭ��֮��ľ���Ϊanm��������ܶ�Ϊbg��cm��3�����ӵ�����Ϊ_________ mol��1(�ú�a��b�Ĵ���ʽ��ʾ)

���𰸡��� 3d64s2 �Ǽ��� sp3 BD B��Be��C 2 ������ ![]() ��1021
��1021
��������
(1) ��(Nd)Ϊ60��Ԫ�أ�����ϡ�������ԭ�����������жϣ���Ϊ26��Ԫ�أ��ݴ���д��̬��ԭ�ӵ���Χ�����Ų�ʽ��
(2)��Al2Cl6������������������غϣ�ÿ����ԭ�Ӻ��ĸ���ԭ���γɹ��ۼ�����Al3+��OH-֮��Ϊ��λ����O��H֮����ڹ��ۼ���
(3) ����ͬ���ڵ�һ�����ܵı仯�����жϣ�Ԫ�صķǽ�����Խǿ���縺��Խ�û������е縺������Ԫ����F������F�ĵ����Ų�ʽ�ж������ܲ���ӵĵ���������ͼ��״��
(4) [Ni(NH3)6]Cl2���������Ϊ���������ݼ۲���Ӷ���=�������Ӷ���+�µ��Ӷ���=�������Ӷ���+![]() (a-xb)����Nԭ�ӵļ۲���Ӷ��������жϿռ乹�ͣ�
(a-xb)����Nԭ�ӵļ۲���Ӷ��������жϿռ乹�ͣ�
(5) ���ݾ�̯������ÿ�������к��е�Nԭ�ӡ�Bԭ����Ŀ���ټ��㾧���������������������B��Nԭ��֮��ľ���Ϊanm��Ϊ������Խ��ߵ�![]() ���ɴ˼��㾧�����ⳤ��ȷ������������������ݾ������ܶ���ʽ���㡣
���ɴ˼��㾧�����ⳤ��ȷ������������������ݾ������ܶ���ʽ���㡣
(1) ��(Nd)Ϊ60��Ԫ�أ�����ϡ�������ԭ��������֪��60��54��Ϊ�����������(Nd)�����ڱ��ĵ�6���ڢ�B�壻��Ϊ26��Ԫ�أ���̬��ԭ�ӵ���Χ�����Ų�ʽΪ3d64s2���ʴ�Ϊ��6��3d64s2��
(2)��Al2Cl6������������������غϣ����ڷǼ��Է��ӣ�ÿ����ԭ�Ӻ��ĸ���ԭ���γɹ��ۼ���Al��ȡsp3�ӻ����ʴ�Ϊ���Ǽ��ԣ�sp3��
��[A1(OH)4]����Al3+��OH-֮��Ϊ��λ����O��H֮����ڹ��ۼ����ʴ�Ϊ��BD��
(3) ͬһ���ڣ������ң�Ԫ�صĵ�һ�����ܳ��������ƣ�����IIA�塢��VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�أ�BԪ�ؼ�����ͬ�������ڵ�����Ԫ�ص�һ��������С�����˳��ΪB��Be��C��BԪ�ؿ���һ������������H3O+ [B(OH)F3]����Ԫ�صķǽ�����Խǿ���縺��Խ�û������е縺������Ԫ����F����̬Fԭ�ӵĵ����Ų�ʽΪ1s22s22p5�������ܲ���ӵĵ���������ͼ��״��2�֣��ʴ�Ϊ��B��Be��C��2��
(4) [Ni(NH3)6]Cl2���������Ϊ������Nԭ�ӵļ۲���Ӷ���=3+![]() =4��N����sp3�ӻ����ռ乹��Ϊ�����Σ��ʴ�Ϊ�������Σ�
=4��N����sp3�ӻ����ռ乹��Ϊ�����Σ��ʴ�Ϊ�������Σ�
(5) ��ͼ��֪ÿ�������к�4��Nԭ�ӣ�Bԭ����Ϊ8��![]() +6��
+6��![]() =4��ÿ������������=
=4��ÿ������������=![]() g�������������B��Nԭ��֮��ľ���Ϊanm��Ϊ������Խ��ߵ�
g�������������B��Nԭ��֮��ľ���Ϊanm��Ϊ������Խ��ߵ�![]() �������ⳤ=
�������ⳤ=![]() a nm=
a nm=![]() a��10-7 cm����˾������ܶ�bg��cm��3=
a��10-7 cm����˾������ܶ�bg��cm��3=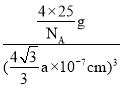 ����ã�NA=
����ã�NA=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ɳ��������һ������ҩ������ڻ��������ȷβ���������һ�ֺϳ�·����ͼ��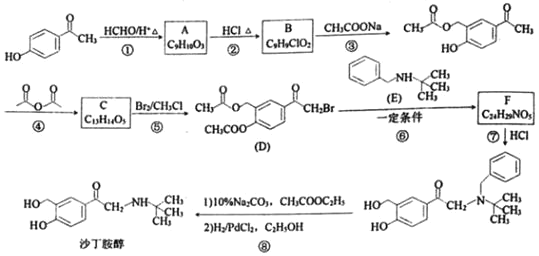
��֪��RX+![]() ��
��![]() +HX
+HX
��ش�
��1��������C�Ľṹ��ʽΪ___��
��2����Ӧ�ߵĻ�ѧ����ʽΪ___��
��3������˵������ȷ����___��
A��������A����FeCl3��Һ������ɫ��Ӧ
B��������B�ܷ�����ȥ��Ӧ
C��1 mol ������D�������3mol NaOH��Ӧ
D��ɳ�������ķ���ʽΪC13H19NO3
��4��д��ͬʱ�������������Ļ�����E������ͬ���칹��Ľṹ��ʽ___��
��IR�ױ��������к��Щ�NH2�����뱽��ֱ��������
��1H��NMR����ʾ�����������ֲ�ͬ��ѧ��������ԭ�ӣ��ұ�����ֻ��һ����ԭ�ӡ�
��5��������Լױ����춡ϩ[CH2=C��CH3��2]Ϊԭ�Ϻϳɻ�����E�ĺϳ�·��___��������ͼ��ʾ�����Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ܱ������г���CO2��H2���з�Ӧ��2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ��H�����ô����ʹ����ҷֱ���������Ӧ����÷�Ӧ������ͬʱ��ʱCO2��ת������(CO2)�淴Ӧ�¶�T�ı仯��������ͼ��ʾ(�����¶ȶԴ������Ե�Ӱ��)��
CH3OCH3(g)+3H2O(g) ��H�����ô����ʹ����ҷֱ���������Ӧ����÷�Ӧ������ͬʱ��ʱCO2��ת������(CO2)�淴Ӧ�¶�T�ı仯��������ͼ��ʾ(�����¶ȶԴ������Ե�Ӱ��)��
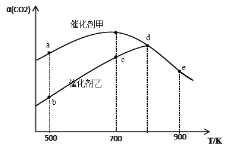
����������ȷ����
A. �ÿ��淴Ӧ����H>0
B. �����������·�Ӧ�Ļ�ܱȴ����������·�Ӧ�Ļ�ܴ�
C. 500K�´ﵽƽ��ʱ����Ӧ�ڴ����������µ�ת���ʱ��ڴ����������µ�ת���ʸ�
D. d��e���㷴Ӧ�Ѿ��ﵽƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǰ�����Ҫ�����ֹ��̲��ϣ��ѹ㷺Ӧ���ں��ա����졢���ס�Һ�������������ij�����ǰ��ĺϳ�·�����£����ַ�Ӧ������ȥ����
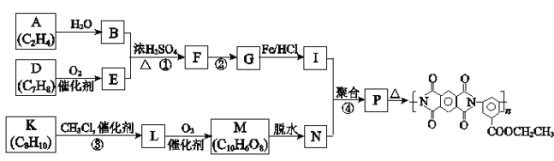
��֪:
i��![]()
ii��![]()
iii��CH3COOH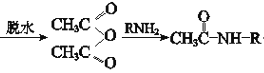 +CH3COOH(R��������)
+CH3COOH(R��������)
��1��A���������ŵ�������________��
��2���ٷ�Ӧ�Ļ�ѧ����ʽ��________��
��3���ڷ�Ӧ�ķ�Ӧ������________��
��4��I�ķ���ʽΪC9H12O2N2��I�Ľṹ��ʽ��________��
��5��K��D��ͬϵ��˴Ź���������ʾ����4��壬�۵Ļ�ѧ����ʽ��________��
��6��1 mol M��������NaHCO3��Һ��Ӧ����4 mol CO2��M�Ľṹ��ʽ��________��
��7��P�Ľṹ��ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����pH��Ϊ2 ��HCl��HX ����Һ�ֱ��ˮϡ�ͣ���ҺpH����Һ����仯��������ͼ��ʾ������˵������ȷ����
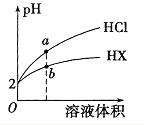
A. a��b����: c(X-) < c(Cl-) B. ��Һ�ĵ�����: a < b
C. ϡ��ǰ��c(HX) > 0.01mol/L D. ��Һ���ϡ�͵�10����HX ��Һ��pH < 3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ�������X2 (g)+2Y2 (g)![]() Z(g)�ķ�Ӧ��X2��Y2��Z����ʼŨ������Ϊ0.2mol/L��0.3mol/L��0.3mol/L������Ӧ�ﵽ�������(����ѧƽ��״̬)ʱ�������ʵ�Ũ���п��ܵ���( )
Z(g)�ķ�Ӧ��X2��Y2��Z����ʼŨ������Ϊ0.2mol/L��0.3mol/L��0.3mol/L������Ӧ�ﵽ�������(����ѧƽ��״̬)ʱ�������ʵ�Ũ���п��ܵ���( )
A.c(Z) �T0.45mol/LB.c(X2) �T0.3mol/L
C.c(X2) �T0.5mol/LD.c(Y2) �T0.5mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����е�������18O����������Ҵ���һ�������·�Ӧ�������㹻����ʱ�����ϵ�к���18O��������
A. ֻ������
B. ֻ����������
C. ���ᡢ����������ˮ
D. �����������Ҵ���ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪӲ֬��������ڼ���������ˮ���װ��ͼ������������Ӧ�IJ������£�
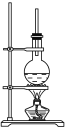
��1������ƿ��װ��7��8 gӲ֬���������Ȼ�����2��3 g��NaOH��5 mL H2O��10 mL�ƾ�������ƾ���������________________________________________________________��
��2��ͼ�г��������ܵ�������_______________________________________��
��3���÷�Ӧ�Ļ�ѧ����ʽ��______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.4molX�����0.6molY��������2L�ܱ������У�ʹ���Ƿ������·�Ӧ��4X(g)+5Y(g) ![]() nZ(g)+6W(g)��2minĩ������0.3molW������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05mol/(L��min)���Լ���
nZ(g)+6W(g)��2minĩ������0.3molW������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05mol/(L��min)���Լ���
��1��ǰ2min����W��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ_______________��
��2��2minĩʱY��Ũ��Ϊ_____________________________��
��3����ѧ��Ӧ����ʽ��n=_____________________________��
��4��2minĩ���ָ�����Ӧǰ�¶ȣ���ϵ��ѹǿ�Ƿ�Ӧǰѹǿ��__________����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com