
【题目】在密闭容器中X2 (g)+2Y2 (g)![]() Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
A.c(Z) ═0.45mol/LB.c(X2) ═0.3mol/L
C.c(X2) ═0.5mol/LD.c(Y2) ═0.5mol/L
【答案】BD
【解析】
X2、Y2、Z的起始浓度依次为0.2 mol/L、0.3mol/L、0.3mol/L,如果该反应向正反应方向进行,则X2、Y2浓度降低、Z浓度增大,如果该反应向逆反应方向进行,则该反应中Z浓度降低,而X2、Y2浓度增大;
①如果该反应向正反应方向进行,且Y2完全反应;

②如果该反应向逆反应方向进行,且Z完全反应;

实际上该反应可能向正反应方向进行也可能向逆反应方向进行,①中X2、Y2浓度最小而Z浓度最大,②中X2、Y2浓度最大而Z浓度最小,实际上这几种物质浓度介于最大和最小之间,即:0.05 mol/L<c(X2)<0.5 mol/L、0<c(Y2)<0.9 mol/L、0<c(Z)<0.45 mol/L;
A.分析知0<c(Z)<0.45,则c(Z) ═0.45mol/L不可能成立,故A错误;
B.0.05<c(X2)<0.5,则c(X2) ═0.3mol/L可能成立,故B正确;
C.0.05<c(X2)<0.5,则c(X2) ═0.5mol/L不可能成立,故C错误;
D.0<c(Y2)<0.9,则c(Y2) ═0.5mol/L可能成立,故D正确;
故答案为BD。


科目:高中化学 来源: 题型:
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如下图所示:

下列说法正确的是
A. 电流由a极沿导线流向b极
B. 每转移1 mol e-,标准状况下,消耗O2 2.8L
C. 微生物所在电极区放电时发生还原反应
D. 负极的电极反应式为HS-+4H2O-8e-=SO42-+9H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①Na2CO3溶液 ②NaOH固体 ③CO2 ④石墨 ⑤熔融BaCl2五种物质,按要求回答下列问题:
(1)属于电解质的是____________(填代号,下同);属于非电解质的是____________;能导电的是______________。
(2)上述物质中有些物质在一定条件下可以反应,请按要求写出相应的化学方程式:
①是化合反应,也是氧化还原反应_________________________________。
②是化合反应,不是氧化还原反应_________________________________。
③是复分解反应,且有沉淀生成__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料岀现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其他稀土原料。
(1) 钕(Nd)为60号元素,在周期表中第______周期;基态铁原子的外围电子排布式为______
(2) 实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。

① 已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于_________分子(填“极性”或“非极性”),分子中A1原采取______杂化。
② Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_____ (填选项字母)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(3) B元素及与其同周期相邻的两种元素第一电离能由小到大的顺序为______(用元素符号表示)。B元素可在一定条件下生成H3O+ [B(OH)F3]- ,该化合物中电负性最大的元素的原子中,所有能层电子的电子云轮廓图形状有______种
(4) 因材料中含有大量的钕和铁,容易锈蚀是它的一大弱点。可电镀镍(Ni)、锌(Zn)等进行表面涂层处理。已知Ni可以形成[Ni(NH3)6]Cl2,该配合物中配体分子的空间构型为 _______ 。
(5) 已知立方BN晶体硬而脆,其晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为anm,晶体的密度为bg·cm-3,则阿伏加德罗常数为_________ mol-1(用含a、b的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际奥委会公布的违禁药物有138种,其中某种兴奋剂分子结构如图,关于它的说法正确的是( )

A. 该物质属于芳香烃
B. 该分子中所有碳原子共面
C. 1mol该物质与氢氧化钠溶液完全反应,最多消耗2molNaOH
D. 该物质的化学式为C15H24ClNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )
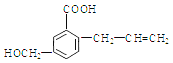
A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由Cu片、Zn片和200mL稀H2SO4组成的原电池中,当Cu片上放出2.24L(标准状况下)H2时,H2SO4恰好用完。问:
(1)此时在导线上有________mol电子通过。
(2)Zn片溶解的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如下图所示。此方法既能实现有效清除氮氧化物的排放,减轻环污染,又能充分利用化学能。下列说法正确的是( )

A.电流从左侧A电极经过负载后流向右侧B电极
B.电极B为正极,发生还原反应
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有4.48LNO2被处理时,转移电子数为0.8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com