
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
科目:高中化学 来源: 题型:
【题目】将8.4g Fe投入浓硝酸中,产生红棕色气体A,把所得溶液减压蒸干,得到30g Fe(NO3)2和Fe(NO3)3的混合物,将该固体隔绝空气在高温下加热,得到红棕色的Fe2O3和气体B,A、B气体混合通入足量水中得到硝酸和NO,在标准状况生成NO气体的体积为
A. 1120mL B. 2240mL C. 3360mL D. 4480mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是( )
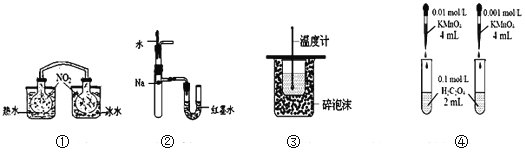
A. 装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)![]() N2O4(g)平衡移动的方向
N2O4(g)平衡移动的方向
B. 装置②依据U管两边液面的高低判断Na和水反应的热效应
C. 装置③测定中和热
D. 装置④依据褪色快慢比较浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J是一种防止血管中血栓形成与发展的药物,其合成路线如图所示(部分反应条件略去)。
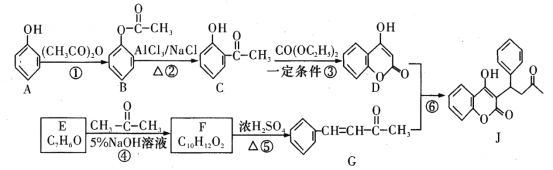
请回答下列问题:
(1)B的名称为______________,反应⑥的反应类型是__________。
(2)J含有_______种官能团。F的结构简式是_____________。
(3)反应③的化学方程式为____________________________________________-。
(4)写出同时满足下列条件的F的同分异构体的结构简式:______________(至少写两种)。
①苯环上只有两个处于对位的取代基;
②1 mol该有机物能与含2 mol NaOH的溶液恰好完全反应。
(5)参照D的合成路线,设计一种以![]() 为原料制备
为原料制备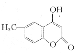 的合成路线__________。
的合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0℃ | 0.5 mol·L-1稀硫酸 | 4min左右出现蓝色 |
② | 20℃ | 1min左右出现蓝色 | ||
③ | 20℃ | 0.1 mol·L-1 稀硫酸 | 15min左右出现蓝色 | |
④ | 20℃ | 蒸馏水 | 30min左右出现蓝色 |
(1)为探究温度对反应速率的影响,实验②中试剂A应为_______ 。
(2)写出实验③中I-反应的离子方程式___________。
(3)对比实验②③④,可以得出的结论是__________。
(继续探究)溶液pH对反应速率的影响
查阅资料:
i.pH<11.7时,I-能被O2氧化为I2。
ii.pH>9.28时,I2发生歧化反应:3I2+6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快
(4)小组同学用4支试管在装有O2储气瓶中进行实验,装置如图所示:
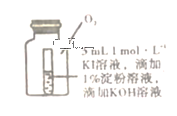
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的pH | 8 | 9 | 10 | 11 |
放置10小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
pH为10、11时,试管⑦和⑧中颜色无明显变化的原因是________(填序号)。
A.既发生氧化反应又发生歧化反应,歧化反应速率大于氧化反应速率和淀粉变色速率
B.既发生氧化反应又发生歧化反应,歧化反应速率小于氧化反应速率和淀粉变色速率
C.发生了氧化反应,但没有发生歧化反应
D.发生了歧化反应,但没有发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列四种微粒:①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]()
(1)按原子半径由大到小顺序排列的是________________________(用序号回答,下同)
(2)微粒中质子数小于中子数的是______________________________
(3)在化合物中呈现的化合价的数值最多的是____________________
(4)能形成X2Y2型化合物的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)B的氢化物的分子空间构型是_____。其中心原子采取___杂化。
(3)写出化合物AC2的电子式____;一种由B、C组成的化合物与AC2互为等电子体,其化学式为_____。
(4)ECl3与B、C的氢化物形成配位数为六的配合物的化学式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是
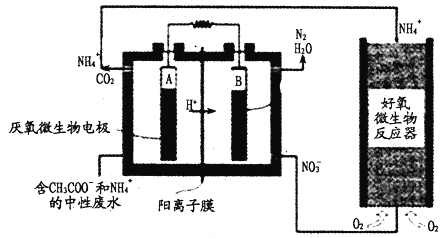
A. 好氧微生物反应器中反应为:NH4++2O2==NO3-+2H++H2O
B. B极电势比A极电势低
C. A极的电极反应式CH3COO-+8e-+2H2O==2CO2+7H+
D. 当电路中通过1mol电子时,理论上总共生成2.24LN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1个 |
C元素原子的第一至第四电离能分别是:I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)B基态原子中能量最高的电子,其电子云在空间有_____个方向,原子轨道呈___形
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为![]()
![]() 该同学所画的电子排布图违背了____。
该同学所画的电子排布图违背了____。
(3)G位于______族______区,价电子排布式为______。
(4)检验F元素的实验方法是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com