
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应的步骤如下:
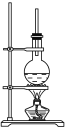
(1)在烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的NaOH、5 mL H2O和10 mL酒精。加入酒精的作用是________________________________________________________。
(2)图中长玻璃导管的作用是_______________________________________。
(3)该反应的化学方程式是______________________________________。
科目:高中化学 来源: 题型:
【题目】实验室制取Fe(OH)3胶体的方法是把______逐滴加在_______中,继续煮沸,待溶液呈____ 色时停止加热,其反应的离子方程式为_______________,用 __________(方法)可证明胶体已经制成,用_____方法精制胶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料岀现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其他稀土原料。
(1) 钕(Nd)为60号元素,在周期表中第______周期;基态铁原子的外围电子排布式为______
(2) 实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。

① 已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于_________分子(填“极性”或“非极性”),分子中A1原采取______杂化。
② Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_____ (填选项字母)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(3) B元素及与其同周期相邻的两种元素第一电离能由小到大的顺序为______(用元素符号表示)。B元素可在一定条件下生成H3O+ [B(OH)F3]- ,该化合物中电负性最大的元素的原子中,所有能层电子的电子云轮廓图形状有______种
(4) 因材料中含有大量的钕和铁,容易锈蚀是它的一大弱点。可电镀镍(Ni)、锌(Zn)等进行表面涂层处理。已知Ni可以形成[Ni(NH3)6]Cl2,该配合物中配体分子的空间构型为 _______ 。
(5) 已知立方BN晶体硬而脆,其晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为anm,晶体的密度为bg·cm-3,则阿伏加德罗常数为_________ mol-1(用含a、b的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )
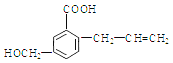
A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,有关金属的腐蚀与防护的叙述正确的是

A.钢闸门含铁量高,无需外接电源保护
B.该装置的原理是“牺牲阳极的阴极保护法”
C.将钢闸门与直流电源的负极相连可防止其被腐蚀
D.辅助电极最好接锌质材料的电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由Cu片、Zn片和200mL稀H2SO4组成的原电池中,当Cu片上放出2.24L(标准状况下)H2时,H2SO4恰好用完。问:
(1)此时在导线上有________mol电子通过。
(2)Zn片溶解的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中的一部分,表中列出8种元素在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ④ | ⑥ | ||||||
3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ |
(1)在①~⑧元素中化学性质最不活泼的元素的名称是____,金属性最强的元素的名称是____。
(2)③、④、⑥三种元素中的原子半径最小的是_____________(填元素符号)。
(3)①、②、③三种元素形成的离子,离子半径由大到小的顺序是____(用离子符号填写)。
(4)④与⑥形成的化合物的电子式为_____________。
(5)写出①和③两种元素的最高价氧化物对应的水化物相互反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如右图所示。
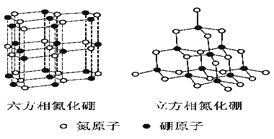
⑴基态硼原子的电子排布式为______________________________。
⑵ 关于这两种晶体的说法,正确的是_________________(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键 d.两种晶体均为分子晶体
⑶六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是______________________________。
⑷立方相氮化硼晶体中,硼原子的杂化轨道类型为___________________。该晶体的天然矿物在青藏高原在下约300Km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是____________________________。
⑸NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mo NH4BF4含有_____________mol配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组为研究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。回答下列问题:
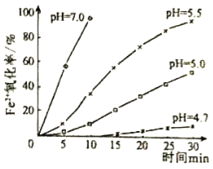
(1)写出Fe2+水解的离子方程式______;要抑制FeSO4水解,可以采取的措施是______。
(2)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O24Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是______。
a.Fe2+转化为Fe3+的趋势很大 b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全 d.酸性条件下Fe2+不会被氧化
(3)结合如图分析不同pH对Fe2+被O2氧化的反应发生了怎样的影响______。
(4)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是______。
(5)用K2Cr2O7标准溶液测定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O若取20mL待测溶液,用0.0200molL-1KCr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=______molL-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com