
【题目】实验室制取Fe(OH)3胶体的方法是把______逐滴加在_______中,继续煮沸,待溶液呈____ 色时停止加热,其反应的离子方程式为_______________,用 __________(方法)可证明胶体已经制成,用_____方法精制胶体。
【答案】FeCl3饱和溶液 沸水 红褐 Fe3++3H2O ![]() 3H++Fe(OH)3(胶体) 丁达尔现象 渗析
3H++Fe(OH)3(胶体) 丁达尔现象 渗析
【解析】
向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,即制得Fe(OH)3胶体;胶体具有丁达尔效应,胶体不能通过半透膜,据此分析解答。
(1)实验室制备氢氧化铁胶体原理是在加热条件下,三价铁离子水解生成氢氧化铁胶体,其操作为:将烧杯的蒸馏水加热至沸腾,向沸水中逐滴加入饱和的FeCl3溶液,继续加热至溶液呈红褐色,停止加热,即得到Fe(OH)3 胶体,反应的化学方程式:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl,离子方程式为Fe3++3H2O
Fe(OH)3(胶体)+3HCl,离子方程式为Fe3++3H2O ![]() 3H++Fe(OH)3(胶体),用丁达尔效应可以验证胶体的生成,胶体不能通过半透膜,溶液能够通过半透膜,利用渗析的方法可以分离提纯胶体。
3H++Fe(OH)3(胶体),用丁达尔效应可以验证胶体的生成,胶体不能通过半透膜,溶液能够通过半透膜,利用渗析的方法可以分离提纯胶体。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】维生素C又叫抗坏血酸,是一种水溶性维生素,只含有C、H、O三种元素,其球棍模型如图所示。下列关于维生素C的说法正确的是( )
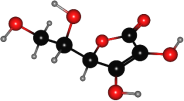
A.维生素C的分子式C6H8O6
B.维生素C含有1个手性碳原子
C.维生素C不能使溴水褪色
D.1mol维生素C与足量的钠反应能产生2molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沙丁胺醇是一种新型药物,常用于缓解哮喘等肺部疾病,其一种合成路线如图: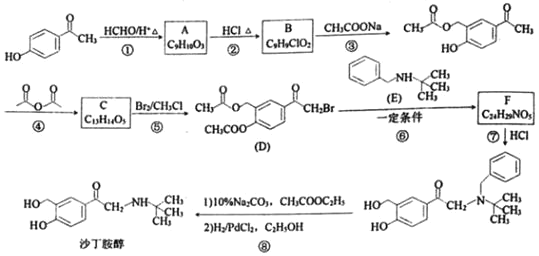
已知:RX+![]() →
→![]() +HX
+HX
请回答:
(1)化合物C的结构简式为___。
(2)反应⑦的化学方程式为___。
(3)下列说法不正确的是___。
A.化合物A能与FeCl3溶液发生显色反应
B.化合物B能发生消去反应
C.1 mol 化合物D最多能与3mol NaOH反应
D.沙丁胺醇的分子式为C13H19NO3
(4)写出同时符合下列条件的化合物E的所有同分异构体的结构简式___。
①IR谱表明分子中含有﹣NH2,且与苯环直接相连;
②1H﹣NMR谱显示分子中有五种不同化学环境的氢原子,且苯环上只有一种氢原子。
(5)请设计以甲苯和异丁烯[CH2=C(CH3)2]为原料合成化合物E的合成路线___(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. SiO2、SiCl4的相对分子质量不同,所以沸点不同
B. NH4C1与NaOH所含化学键类型和晶体类型均相同
C. 金属Ag的堆积方式是面心立方最密堆积
D. CO2与水反应过程中,有共价键的断裂和形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被誉为“21世纪的金属”,工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg ![]() Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的价电子排布式为____________________;
(2)写出与CO互为等电子体的分子_________________;
(3)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体.
①TiCl4为______化合物(填“离子”或“共价”);
②TiCl4分子为正四面体形,则Ti为___________杂化.
③TiCl4在潮湿空气中水解的化学方程式是____________________;
④TiCl2、Cl2和C反应制得的TiCl4最好的提纯方法是__________(填操作名称)。
(4)配离子[TiCl(H2O)5]2+的中心离子化合价为_______,中心离子配位数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是关于农作物A、B在相同土壤中N、P、K三元素肥效实验的结果记录,“+”表示施肥,“―”表示未施肥)。请据表中的数据,判断正确的结论是( )
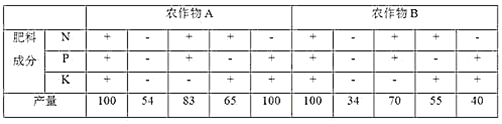
A. 对于农作物A来说,其生长发育不需要N元素
B. 对农作物A来说,施肥时最重要的是施加P肥
C. 对农作物B来说,三种元素中K最重要
D. 两种农作物对土壤中N、P、K的需求量基本相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中充入CO2与H2进行反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
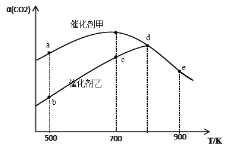
下列叙述正确的是
A. 该可逆反应的ΔH>0
B. 催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能大
C. 500K下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率高
D. d、e两点反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酰亚胺是重要的特种工程材料,已广泛应用在航空、航天、纳米、液晶、激光等领域。某聚酰亚胺的合成路线如下(部分反应条件略去)。
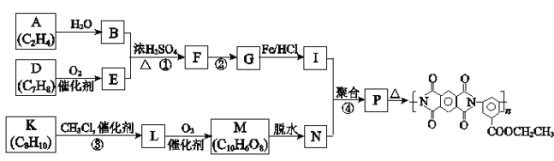
已知:
i、![]()
ii、![]()
iii、CH3COOH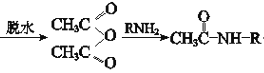 +CH3COOH(R代表烃基)
+CH3COOH(R代表烃基)
(1)A所含官能团的名称是________。
(2)①反应的化学方程式是________。
(3)②反应的反应类型是________。
(4)I的分子式为C9H12O2N2,I的结构简式是________。
(5)K是D的同系物,核磁共振氢谱显示其有4组峰,③的化学方程式是________。
(6)1 mol M与足量的NaHCO3溶液反应生成4 mol CO2,M的结构简式是________。
(7)P的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应的步骤如下:
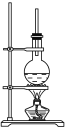
(1)在烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的NaOH、5 mL H2O和10 mL酒精。加入酒精的作用是________________________________________________________。
(2)图中长玻璃导管的作用是_______________________________________。
(3)该反应的化学方程式是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com