
【题目】钛(Ti)被誉为“21世纪的金属”,工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。其反应如下:
①TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
②TiCl4+2Mg ![]() Ti+2MgCl2
Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的价电子排布式为____________________;
(2)写出与CO互为等电子体的分子_________________;
(3)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体.
①TiCl4为______化合物(填“离子”或“共价”);
②TiCl4分子为正四面体形,则Ti为___________杂化.
③TiCl4在潮湿空气中水解的化学方程式是____________________;
④TiCl2、Cl2和C反应制得的TiCl4最好的提纯方法是__________(填操作名称)。
(4)配离子[TiCl(H2O)5]2+的中心离子化合价为_______,中心离子配位数为_______。
【答案】3d24s2 N2 共价 sp3 TiCl4+3H2O=H2TiO3↓+4HCl 蒸馏 +3 6
【解析】
(1)Ti的原子序数为22,位于周期表中的第四周期第ⅣB族;
(2)等电子体中原子数和价电子数都相同;
(3)①根据题目中提供的物理性质来判断晶体类型从而判断化合物类型;
②可根据分子的构型来判断杂化方式;
③TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体,据此写出方程;
④TiO2、Cl2和C反应制得的TiCl4最好的提纯方法是在氯化氢有氛围中蒸馏;
(4)配离子[TiCl(H2O)5]2+中Cl-、H2O含有孤对电子对是配体,根据离子电荷判断中心离子Tin+的电荷;根据配体数目判断配位数。
(1)Ti的原子序数为22,位于周期表中的第四周期第ⅣB族,其电子排布为[Ar]3d24s2,所以Ti元素原子的价电子排布式为3d24s2;
(2)等电子体中原子数和价电子数都相同,则N2、CN-、CO的原子数都是2,价电子数都是10,则互为等电子体,故互为等电子体的分子是N2;
(3)①已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,由此可判断TiCl4是由共价键结合的分子;
②TiCl4分子为正四面体形,Ti和Cl形成4个δ键,所以Ti为sp3杂化;
③TiCl4在潮湿空气中易水解产生白雾说明生成HCl,同时产生H2TiO3固体,所以其反应方程式为:TiCl4+3H2O=H2TiO3↓+4HCl;
④TiO2、Cl2和C反应制得的TiCl4最好的提纯方法是在氯化氢有氛围中蒸馏;
(4)配离子[TiCl(H2O)5]2+的中心离子所带的电荷2+1=3,故中心离子为Ti3+,中心离子Ti3+的化合价为+3价,Cl-、H2O含有孤对电子对是配体,配位数是6。


科目:高中化学 来源: 题型:
【题目】如图中化合物B既能使溴水褪色,又能溶解碳酸钙,D、E均为高分子化合物。根据下图填空:

(1)写出葡萄糖与新制氢氧化铜浊液反应的化学方程式:_____。
(2)A中的官能团有_____(写结构简式)。
(3)E在自然界中可降解,对环境无害,下列说法正确的是___。
A.由A生成E的反应属于加聚反应
B.E的相对分子质量为72
C.E用作一次性快餐盒有助于减少白色污染
(4)在反应①-⑤中,属于取代反应的是_____。写出D和F的结构简式:D_______,F_______。
(5)A跟氢氧化钙作用可制得一种常用的人体补钙剂,测得这种补钙剂的纯净物中钙元素的质量分数为13.0%,其结晶水的含量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠—过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.7700g样品,配制成100.00mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g。
③准确量取25.00mL溶液A,加适量稀硫酸酸化后,用0.02000mol·L—1KMnO4溶液至终点,消耗KMnO4溶液25.00mL。H2O2与KMnO4反应的离子方程式如下:
2MnO4— + 5H2O2 + 6H+ =2Mn2+ + 8H2O +5O2↑。
通过计算确定样品的组成(写出必要的计算过程)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A 与 H2、CO 以物质的量 1∶1∶1 的比例形成 B,B能发生银镜反应,C 分子中只有一种氢,相关物质转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
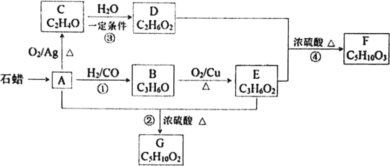
请回答:
(1)有机物 C 的结构简式是________,反应②的反应类型是________。
(2)写出一定条件下发生反应①的化学方程式___________。
(3)下列说法不正确的是________(填字母)。
A.化合物 A 属于烃
B.化合物 D 含有两种官能团
C.用金属钠无法鉴别化合物 F、G
D.A 与 D 一定条件下可以生成 CH3CH2OCH2CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N元素的单质及其化合物之间的转化关系:NH3N2NO NO2HNO3。回答下列问题:
(1)N元素在元素周期表中的位置为_______;
(2)上述四种气体只能用排水法收集的是_______(填化学式,下同),只能用排空气法收集的是______;
(3)氮的氧化物是空气的主要污染物,下列环境问题与氮的氧化物排放有关的是_____;
A. 酸雨 B. 光化学烟雾 C. 白色污染 D. 臭氧层空洞
(4)NO2形成酸雨的化学方程式为______;
(5)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程______;
(6)若将12.8 g铜与 50 mL一定浓度的浓硝酸反应,两者恰好完全反应共产生气体5.6 L(标准状况),计算此浓硝酸的物质的量浓度_______(写出解题过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取Fe(OH)3胶体的方法是把______逐滴加在_______中,继续煮沸,待溶液呈____ 色时停止加热,其反应的离子方程式为_______________,用 __________(方法)可证明胶体已经制成,用_____方法精制胶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 浓度是影响化学反应速率的本质因素
B. 在容积可变的密闭容器中,发生反应H2(g)+I2(g) ![]() 2HI(g),把容积缩小一倍,正反应速率加快,平衡正向移动
2HI(g),把容积缩小一倍,正反应速率加快,平衡正向移动
C. 反应 MgCl2(l)=Mg(l)+Cl2(g)的 △H<0、△S>0
D. 化学反应速率可用单位时间内反应物的浓度变化量来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用氯氧化法处理含氰(CN-)废水,一定条件下,氯气和CN-反应生成无毒气体N2和CO2。下列说法不正确的是( )
A.CN-中碳元素的化合价为+2B.该反应的氧化产物是N2
C.反应中氧化剂和还原剂的系数比为5:2D.该反应的还原产物为Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,有关金属的腐蚀与防护的叙述正确的是

A.钢闸门含铁量高,无需外接电源保护
B.该装置的原理是“牺牲阳极的阴极保护法”
C.将钢闸门与直流电源的负极相连可防止其被腐蚀
D.辅助电极最好接锌质材料的电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com