
【题目】2018年4月23日,中国人民海军成立69周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。镍铬钢抗腐蚀性能强,可用于建造航母。
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷(结构如图甲所示)。基态Cr原子的价电子排布式为_____________,基态Si原子电子占据最高能级的电子云轮廓图为_____________形,元素C、O、F的电负性由大到小的顺序为_____________。
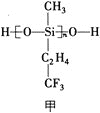
(2)海洋是元素的摇篮,海水中含有大量F、Cl、Br、I元素。
①OF2的空间构型为_____________,其中O原子杂化方式为_____________杂化。
②KCl晶体中存在的化学键类型有_____________;CaCl2熔点要比KCl的熔点高很多,主要原因为____________________________________________________________________。
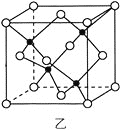
(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶胞结构如图乙所示(黑球表示Zn2+,白球表示S2-),Zn2+的配位数为_____________。晶胞边长为a nm、ZnS相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____________g·cm-3。
【答案】3d54s1 哑铃 F>O>C V形 sp3 离子键 Ca2+半径比K+小,Ca2+所带电荷数比K+多,CaCl2的晶格能更高 4 ![]()
【解析】
(1)依据原子核外电子排布规则写出基态Cr原子的价电子排布式;依据Si的核外电子排布式可知其最高能级为3p能级,3p能级电子云轮廓图为哑铃形;根据C、O、F的非金属性推断其电负性;
(2)①OF2分子的中心原子为O原子,其中含有的孤电子对数为2,σ键数为2,价层电子对数为4,所以OF2的空间构型为V形,其中O原子的杂化方式为sp3杂化;②氯化钾为离子晶体,存在的化学键为离子键;钙离子的半径比钾离子小,钙离子所带电荷数比钾离子多,氯化钙的晶格能更高,所以氯化钙的熔点更高。
(3)通过硫化锌的晶胞结构分析锌离子的周围与之等距离的硫离子,即可知锌离子的配位数;通过硫化锌的晶胞结构可知锌离子的数目为4![]() 1=4,含有硫离子的数目为
1=4,含有硫离子的数目为![]() ,一个晶胞的体积为(a×10-7)3 cm3,由密度公式计算晶体的密度。
,一个晶胞的体积为(a×10-7)3 cm3,由密度公式计算晶体的密度。
(1)Cr为24号元素,核电荷数为24,故基态Cr原子的价电子排布式为3d54s1;Si元素为14号元素,核电荷数为14,核外电子排布式为1s22s22p63s23p2,最高能级为3p能级,3p能级电子云轮廓图为哑铃形;非金属性:F>O>C,则C、O、F的电负性由大到小的顺序为F>O>C。
(2)①OF2分子的中心原子为O原子,其中含有的孤电子对数为2,σ键数为2,价层电子对数为4,所以OF2的空间构型为V形,其中O原子的杂化方式为sp3杂化;②氯化钾为离子晶体,存在的化学键为离子键;钙离子的半径比钾离子小,钙离子所带电荷数比钾离子多,氯化钙的品格能更高,所以氯化钙的熔点更高。
(3)由硫化锌的晶胞结构可知,每个锌离子的周围与之等距离的硫离子有4个,所以锌离子的配位数为4;一个晶胞中含有锌离子的数目为4,含有硫离子的数目为4,一个晶胞的体积为(a×10-7)3 cm3,则晶体的密度为![]() 。
。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.16g O3含有的氧原子数为NA
B.常温常压下,22.4L SO2含有的分子数为NA
C.1molMg变成Mg2+时,失去电子的数目为NA
D.1L 1mol·L-1H2SO4溶液中含H+的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu + Br2=CuBr2。下列说法正确的是( )
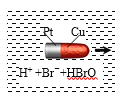
A.铜为电池的正极
B.铂不断溶解
C.电池工作时实现机械能向电能再向化学能转化
D.稀溴水为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠俗称红矾钠![]() ,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:
,是重要的化工产品和强氧化剂.工业制备红矾钠的流程如下:

(1)化学上可将某些盐写成氧化物的形式,如![]() 可写成
可写成![]() ,则
,则![]() 可写成______.
可写成______.
(2)煅烧铬铁矿时,矿石中难溶的![]() 生成可溶于水的
生成可溶于水的![]() ,反应化学方程式如下:
,反应化学方程式如下:![]() 为了加快该反应的反应速率,可采取的措施是______
为了加快该反应的反应速率,可采取的措施是______![]() 写一种即可
写一种即可![]()
(3)已知![]() 在不同的酸性溶液中有不同的反应,如:
在不同的酸性溶液中有不同的反应,如:
![]() ;
;![]()
①往混合溶液甲中加入硫酸必须适量的原因是______.
②混合溶液乙中溶质的化学式是______.
(4)在含![]() 废水中存在着平衡:
废水中存在着平衡:![]() ,请写出该平衡的平衡常数表达式
,请写出该平衡的平衡常数表达式![]() ______,若继续加水稀释,平衡将______移动
______,若继续加水稀释,平衡将______移动![]() 填“正向”、“逆向”“不”
填“正向”、“逆向”“不”![]() .
.
(5)请配平碱性溶液还原法中发生的离子反应:
______![]() ___
___![]() ______
______![]() --______
--______![]() ______
______![]() ______
______![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-lg[c(H+)/c(H2C2O4)]和-lgc(HC2O4-)或-lg[c(H+)/c(HC2O4-)]和-lgc(C2O42-)关系如图所示,下列说法错误的是( )

A. Ka1(H2C2O4)=1×10-2
B. 滴定过程中,当pH=5时,C(Na+)-3C(HC2O4-)>0
C. 向1 mol/L的H2C2O4溶液中加入等体积等浓度的NaOH溶液,完全反应后显酸性
D. 向0.1 mol/L的H2C2O4溶液中加水稀释,C(HC2O4-)/C(H2C2O4)比值将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
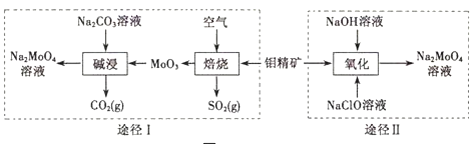
(1)钼和锆同属过渡金属,锆元素是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷.下列关于锆、二氧化锆的叙述中,正确的是______(填序号)
A 锆合金比纯锆的熔点高,硬度小
B 二氧化锆陶瓷属于新型无机非金属材料
C 将一束光线通过纳米级二氧化锆会产生一条光亮的通路
(2)①途径I碱浸时发生反应的离子方程式为______.
②途径Ⅱ氧化时发生反应的离子方程式为______.
(3)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是______.
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图:
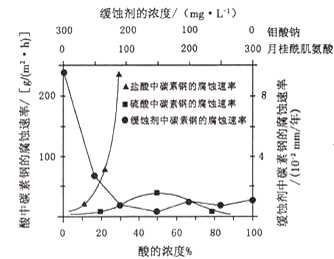
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为______。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是______。
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com