
【题目】H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:H2S+Fe2(SO4)3 =S↓+2FeSO4+H2SO4
4FeSO4+ O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O
2Fe2(SO4)3 +2H2O
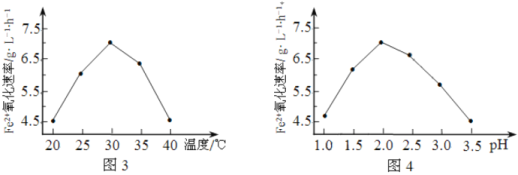
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双减法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+ H2O (l) =Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理______________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_______ mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_____________。
)=_____________。
【答案】降低反应活化能(或作催化剂) 30 ℃、pH=2.0 蛋白质变性(或硫杆菌失去活性) H2SO4 2OH+SO2=![]() +H2O
+H2O ![]() 与Ca2+生成CaSO3沉淀,使Ca(OH)2(s)
与Ca2+生成CaSO3沉淀,使Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)平衡正向移动,生成NaOH; 6.0×103 0.62
Ca2+(aq)+2OH(aq)平衡正向移动,生成NaOH; 6.0×103 0.62
【解析】
(1)硫杆菌存在时,FeSO4被氧化的速率比无菌时更快,该菌的作用可能作该反应的催化剂,降低了反应活化能,因此加快了该化学反应速率,故答案为:降低反应活化能(或作催化剂);
(2)由图可知,30℃、pH=2时Fe2+氧化速率最大,此时硫杆菌的催化效果最好。温度太高,硫杆菌的蛋白质变性,使硫杆菌失去了活性,因而催化效果下降,反应速率减小,故答案为:30 ℃、pH=2.0;蛋白质变性(或硫杆菌失去活性);
(3)n(H2O2)/n(H2S)=4,假设H2O2物质的量为4mol,H2S的物质的量为1mol,H2O2做氧化剂,还原产物中O化合价为-2价,得电子总物质的量=4×2×[-1-(-2)]mol=8mol,H2S作还原剂,设氧化产物中S的化合价为x,则失电子总物质的量=1×[x-(-2)],得失电子总数相等,则8=1×[x-(-2)],解得x=+6,结合原子守恒可知,氧化产物为H2SO4,故答案为:H2SO4;
(4)NaOH溶液和少量SO2反应生成Na2SO3和H2O,离子方程式为:2OH+SO2=![]() +H2O。NaOH再生的原因是:
+H2O。NaOH再生的原因是:![]() 与Ca2+生成CaSO3沉淀,使Ca(OH)2(s)
与Ca2+生成CaSO3沉淀,使Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)平衡正向移动,生成NaOH,故答案为:2OH+SO2=
Ca2+(aq)+2OH(aq)平衡正向移动,生成NaOH,故答案为:2OH+SO2=![]() +H2O;
+H2O;![]() 与Ca2+生成CaSO3沉淀,使Ca(OH)2(s)
与Ca2+生成CaSO3沉淀,使Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)平衡正向移动,生成NaOH;
Ca2+(aq)+2OH(aq)平衡正向移动,生成NaOH;
(5)NH3·H2O![]() NH4++OH-,Ka=
NH4++OH-,Ka=![]() ,1.8×105=
,1.8×105=![]() ,解得:c(OH-)=6.0×103。c(OH)=1.0×107 mol·L1时,则c(H+)=
,解得:c(OH-)=6.0×103。c(OH)=1.0×107 mol·L1时,则c(H+)=![]() =1.0×10-7mol/L,HSO3-
=1.0×10-7mol/L,HSO3-![]() H++SO32-,Ka2=
H++SO32-,Ka2=![]() ,
,![]() =
=![]() =0.62,故答案为: 6.0×103;0.62。
=0.62,故答案为: 6.0×103;0.62。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】现向下列装置中缓慢通入气体X,分别进行关闭和打开活塞K的操作,则品红溶液和澄清石灰水中现象相同的一组是
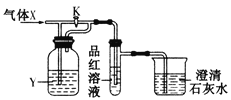
选项 | A | B | C | D |
X | NO2 | SO2 | Cl2 | CO2 |
Y(过量) | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浙江师范大学的研究团队研究获得了一类具有高活性和选择性的钙钛矿光催化剂(![]() ),这一成果发表在2020年1月Chem. Mater.上。带有负电荷的CsPbBr3将带正电的
),这一成果发表在2020年1月Chem. Mater.上。带有负电荷的CsPbBr3将带正电的![]() 固定在其表面,用于可见光驱动CO2还原。
固定在其表面,用于可见光驱动CO2还原。

(1)写出Ni基态原子的价电子排布图(轨道表达式)___________________。
(2)C、N、O、Cs、Pb元素第一电离能由大到小的顺序是____________________。
(3)![]() 是二价阳离子,该离子中氮原子的杂化类型为_________,该离子结构中含有_________(填字母)。
是二价阳离子,该离子中氮原子的杂化类型为_________,该离子结构中含有_________(填字母)。
a.离子键 b.配位键 C.π键 d.氢键
(4)某些氧化物的熔点数据如下表所示:
氧化物 | CO2 | Cs2O | PbO |
熔点/℃ | -56.6 | 490 | 888 |
解释表中氧化物之间熔点差异的原因:______________________________。
(5)氮化镓是一种半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。
①与同一个Ga原子相连的N原子构成的空间构型为__________;
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,则2、3、4原子的分数坐标不可能的是(________________)
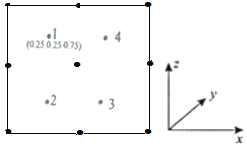
a.(0.75,0.25,0.25) b.(0.25,0.75,0.75)
c.(0.25,0.75,0.25) d.(0.75,0.75,0.75)
③ GaN晶体中N和N的原子核间距为a pm,GaN摩尔质量为![]() ,阿伏加德罗常数的值为NA,则GaN晶体的密度为___________
,阿伏加德罗常数的值为NA,则GaN晶体的密度为___________![]() (
(![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
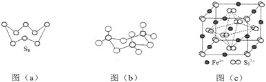
(1)基态S原子电子占据最高能级的电子云轮廓图为__________形。
(2)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为__________形,其中共价键的类型有__________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__________。
(4)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__________。
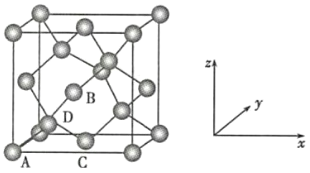
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________g/cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为__________nm。
所形成的正八面体的体心,该正八面体的边长为__________nm。
晶胞有两个基本要素:
(6)晶胞的一个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__________。
,0)。则D原子的坐标参数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述不正确的是( )
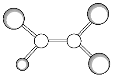
A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有![]()
C.该有机物分子中的所有原子在同一平面上
D.该有机物可以由乙烯和氯化氢加成反应得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示或描述不正确的是
A. Ca的电子排布式是[Ar]3d2
B. BF3 的VSEPR的模型名称是平面三角形
C. NH4+中心原子N上的孤电子对数为0
D. 在[Cu(NH3)4]2+里,NH3的氮原子给出孤电子对,形成配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
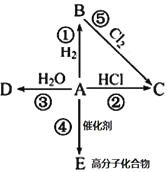
(1)写出A的电子式__________,E的结构简式为__________
(2)写出下列反应化学方程式,并注明③⑤反应类型
②_____________________________________________
③_____________________,反应类型________;
⑤_____________________,反应类型________;
(3)除去B中混有的少量杂质A,所用的试剂为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为_______,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为________________。
(2)现拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯,实验装置如图所示(夹持装置未画出)。
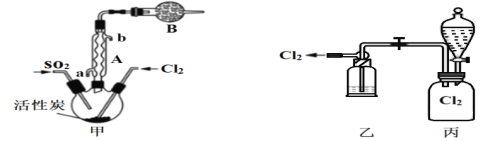
①仪器A的名称为___________,装置乙中装入的试剂_____________,装置B的作用是_______________________。
②装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水 B.10.0 mol/L浓盐酸
C.浓氢氧化钠溶液 D.饱和食盐水
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。
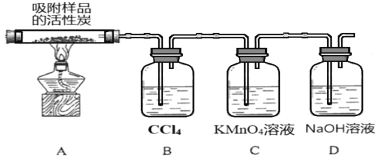
①加热时A中试管出现黄绿色,装置B的作用是 ____________。
②装置C中的现象是___________,反应的离子方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com