
【题目】现向下列装置中缓慢通入气体X,分别进行关闭和打开活塞K的操作,则品红溶液和澄清石灰水中现象相同的一组是
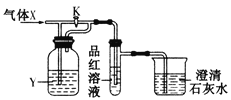
选项 | A | B | C | D |
X | NO2 | SO2 | Cl2 | CO2 |
Y(过量) | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D
【答案】AD
【解析】
A.NO2与浓硫酸不反应,关闭和打开活塞K,通入品红溶液的都是NO2,品红溶液均褪色,出来的气体都是NO,和澄清石灰水都无明显现象,现象相同,故A正确;
B.若关闭活塞K,生成二氧化碳,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,二氧化硫直接通入品红中,则品红溶液褪色,加热后又恢复红色,现象不同,故B错误;
C.若打开活塞K,氯气与水反应生成的次氯酸具有强氧化性,品红溶液褪色,加热品红不能复原,若关闭活塞K,氯气与亚硫酸钠反应生成盐酸和硫酸钠,没有气体放出,则品红溶液无变化,现象不同,故C错误;
D.二氧化碳与NaHSO3饱和溶液不反应,关闭和打开活塞K,通入品红溶液的气体都是二氧化碳,因此现象相同,故D正确;
故选AD。


科目:高中化学 来源: 题型:
【题目】由于电影《我不是药神》中对抗癌药物格列卫的关注,我国政府在2018年已经将格列卫等部分抗癌药物纳入医保用药,解决了人民群众用药负担。格列卫在其合成过程中的一种中间产物结构表示如下: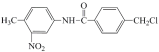 。下列有关该中间产物的说法不正确的是()
。下列有关该中间产物的说法不正确的是()
A. 该药物中间体属于芳香烃
B. 该药物中间体中含有三种官能团
C. 该药物中间体的所有碳原子可能共面
D. 该药物中间体可以发生加成反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge在周期表中的位置__________,基态Ge原子的核外电子排布式为[Ar] _______,有 __________个未成对电子。
(2)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Ge、O两元素电负性由大至小的顺序是 _________。
(3)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为 ________,微粒之间存在的作用力是___________。
(4)晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm(1pm=10-12m),其密度为_______g·cm-3(列出计算式即可)。
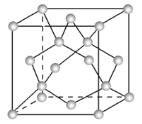
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图,则下列离子组在对应的溶液中一定能大量共存的是
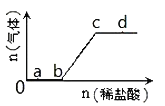
A.a点对应的溶液中:Ca2+、Mg2+、Br-、NO3-
B.b点对应的溶液中:Al3+、Fe3+、MnO4-、NO3-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]一定增大
B. 向0.1 mol·L-1的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大
C. 向0.1 mol·L-1的NaHSO3溶液中加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+c(SO32-)
D. 可用浓度大于0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃[已知Ksp(BaSO4)=1.1×10-10]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)并进行相关实验(装置如图),电解一段时间后,各部分装置及对应的现象为:(1)中黑色固体变红;(2)电极a附近溶液出现浑浊;(3)中溶液出现浑浊;(4)中溶液红色褪去。下列对实验现象解释不正确的是
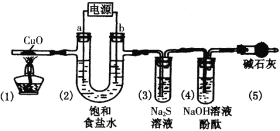
A.(1)中:CuO+H2![]() Cu+H2O
Cu+H2O
B.(2)中a电极:2H2O+2e-=H2↑+2OH-,Mg2++2OH-=Mg(OH)2↓
C.(3)中:Cl2+S2-=S↓+2Cl-
D.(4)中:Cl2具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超分子在生命科学和物理学等领域中具有重要意义。由Mo将2个C60分子、2个p—甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
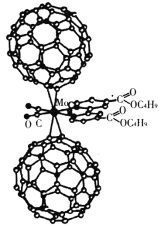
(1)Mo处于第五周期第VIB族,核外电子排布与Cr相似,它的基态价电子排布式是________;核外未成对电子数是________个。
(2)该超分子中配体CO提供孤电子对的原子是________(填元素符号),p—甲酸丁酯吡啶配体中C原子的杂化方式有________。(已知吡啶可看做苯分子中的一个CH原子团被N取代的化合物)
(3)已知:C60分子中存在碳碳单、双键;C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。则一个C60分子的结构是由_____个五边形和____个六边形组成的球体。用文字简述C60跟F2在一定条件下反应所得的物质的组成:__________________。
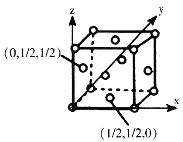
(4)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点的原子坐标均可以为(0,0,0)。钼(Mo)的一种立方晶系的晶体结构中,每个晶胞有2个Mo原子,其中Mo原子坐标是(0,0,0)及(![]() ,
,![]() ,
,![]() )。根据以上信息,推断该晶体的原子堆积方式是_____________。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,阿伏加德罗常数是NA,晶体中距离最近的Mo原子核之间的距离为_____pm。
)。根据以上信息,推断该晶体的原子堆积方式是_____________。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,阿伏加德罗常数是NA,晶体中距离最近的Mo原子核之间的距离为_____pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防治污染要坚决打好蓝天、碧水、净土三大保卫战。某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
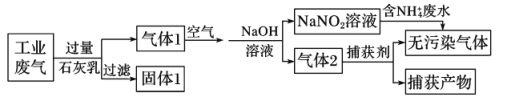
下列说法正确的是( )
A.固体1的成分是CaCO3、CaSO3
B.向气体1中通入的空气需要过量
C.捕获剂所捕获的气体主要是CO
D.处理含NH4+废水时,发生的反应为NH4++5NO2-+4H+=6NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:H2S+Fe2(SO4)3 =S↓+2FeSO4+H2SO4
4FeSO4+ O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O
2Fe2(SO4)3 +2H2O
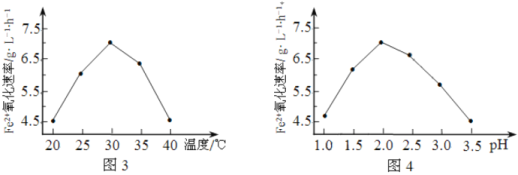
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双减法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+ H2O (l) =Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理______________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_______ mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_____________。
)=_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com