
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液A、B的pH与溶液体积(V)的关系如下图所示:

(1)稀释前起始浓度大小关系:c(A)_____c(B)(填“>”、“<”、“=”)
(2)稀释前向两溶液中分别投入足量锌,开始放H2的速率A_______B,最终得H2体积 A______B。(填“<”“>”“=”)
(3)若使稀释后所得两溶液的pH重新相等,加水量_____________多。
【答案】< = < B
【解析】
(1)一元强酸完全电离,c(酸)=c(H+);弱酸部分电离产生电离平衡,c(酸)>c(H+)。1mL的强酸加水稀释到1000mL,则pH会在原来基础上增加3个单位,酸性强,pH变化幅度大,酸性弱,pH变化幅度小。以此解答;
(2)根据H+判断反应速率大小;根据最终电离产生H+的物质的量确定放出氢气的体积大小;
(3)根据图示,稀释相同倍数时溶液的pH:A>B,若使pH相同,B还需要加水稀释。
(1)1mL的强酸加水稀释到1000mL,则pH会在原来基础上增加3个单位,酸性越强,溶液的pH变化幅度大,酸性弱,pH变化幅度小。因A、B酸的强弱不同,一元强酸来说c(酸)=c(H+),对于一元弱酸,c(酸)>c(H+),根据图示可知:酸A稀释时pH变化较大,说明酸性A>B,所以A、B两种酸溶液的物质的量浓度A<B;
(2)稀释前,两溶液中c(H+)相等,分别向两种酸溶液中投入足量锌,开始放H2的速率A=B,由于酸性A>B,两种溶液的体积相等,则溶液中n(A)<n(B),反应产生H+的物质的量A<B,反应放出氢气的体积取决于溶液中最终电离产生氢离子的物质的量多少,所以最终得H2体积 A<B;
(3)根据图示可知,两种酸溶液稀释相同倍数时溶液的pH:A>B,若使溶液的pH稀释后仍然相同,B还需要加水稀释,即B稀释的倍数大,B加水量多。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

(1)写出负极的电极反应式________________________ 。
(2)石墨电极(C)的电极反应式为___________________。
(3)反应一段时间后,乙装置中生成NaOH主要在 __________(填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中锌先于金属铜放电进入溶液,反应一段时间,硫酸铜溶液浓度将_________ (填“增大”、“减小”或“不变”)
(5)若在标准状况下,有2.24L氧气参加反应,则在乙装置中铁电极上生成的气体在标准状况下的体积为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgCl的Ksp=1.8×10-10。常温下在100 mL 0.01 mol·L-1 KCl溶液中,加入1 mL0.01 mol·L-1 AgNO3溶液,下列说法正确的是 ( )
A.有AgCl沉淀析出B.无AgCl沉淀析出
C.无法确定D.有沉淀但不是AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是
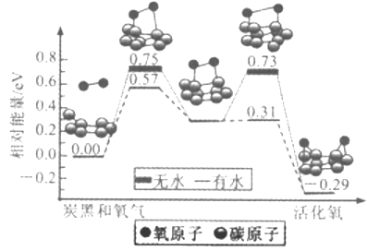
A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有离子:K+、Na+、Fe2+、Fe3+、SO32-、SO42-,且溶液中各离子的物质的量相等,将此溶液分为两份,一份加高锰酸钾溶液,现象为紫色褪去,另一份加氯化钡溶液,产生了难溶于水的沉淀。下列说法正确的是( )
A.若溶液中含有硫酸根,则可能含有K+
B.若溶液中含有亚硫酸根,则一定含有K+
C.溶液中可能含有Fe3+
D.溶液中一定含有Fe2+和SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。据图信息回答:
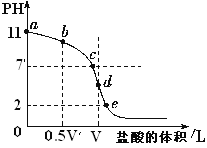
(1)该温度时NH3·H2O的电离常数K=________。
(2)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g))△H<0。测得v正(SO2)随反应时间(t)的变化如图所示。其中在t2时刻改变了某个条件,下列有关说法正确的是( )
2SO3(g))△H<0。测得v正(SO2)随反应时间(t)的变化如图所示。其中在t2时刻改变了某个条件,下列有关说法正确的是( )
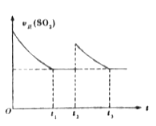
A. t1时平衡常数K1小于t3时平衡常数K2
B. t1时平衡混合气的M1 >t3时平衡混合气的M2
C. t2时刻改变的条件可能是:升温或缩小容器体积
D. t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol·L﹣1盐酸与50mL0.55molL﹣1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中的热量可计算中和热。回答下列问题:

(1)实验中改用60mL0.50mol·L﹣1盐酸跟50mL0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”),所求中和热___(填“相等”或“不相等”),简述理由:___。
(2)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___;用50mL0.50mol·L﹣1CH3COOH溶液(已知CH3COOH电离时吸热)进行上述实验,测得的中和热的数值会___。(均填“偏大”、“偏小”或“无影响”)
(3)平行地做一次这样的实验需要测定___次温度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应2SO2(g)+O2(g)![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,当反应至正、逆反应速率相等时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,当反应至正、逆反应速率相等时,可能存在的数据是( )
A.SO2为0.4mol·L-1、O2为0.2mol·L-1B.SO2为0.25mol·L-1
C.SO2、SO3均为0.15mol·L-1D.SO3为0.4mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com