
【题目】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g))△H<0。测得v正(SO2)随反应时间(t)的变化如图所示。其中在t2时刻改变了某个条件,下列有关说法正确的是( )
2SO3(g))△H<0。测得v正(SO2)随反应时间(t)的变化如图所示。其中在t2时刻改变了某个条件,下列有关说法正确的是( )
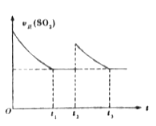
A. t1时平衡常数K1小于t3时平衡常数K2
B. t1时平衡混合气的M1 >t3时平衡混合气的M2
C. t2时刻改变的条件可能是:升温或缩小容器体积
D. t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数
【答案】D
【解析】
A.平衡常数只与温度有关系;
B.根据t3平衡时与t1平衡时是恒温恒压下的等效平衡进行分析;
C.根据化学平衡的移动及其影响因素进行分析;
D.t1 和t3时,平衡状态相同。
A.平衡常数只与温度有关系,一定温度下,故温度不变,则在t1 时平衡常数K1 等于t3 时平衡常数K2,选项A错误;
B.t3平衡时与t1平衡时为恒温恒压下的等效平衡,则t1时平衡混合气的M1等于t3时平衡混合气的M2,选项B错误;
C.若升温平衡向逆反应方向移动,υ正(SO2)突然增大后继续增大直至达到新平衡,若缩小容器体积平衡向正反应方向移动,υ正(SO2)突然增大后减小直至达到新平衡,新平衡时υ正(SO2)大于旧平衡,选项C错误;
D.t3平衡时与t1平衡时为恒温恒压下的等效平衡,t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数,选项D正确。
答案选D。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 反应CaCO3(s)===CaO(s)+CO2(g)在常温下不能自发进行,则该反应的ΔH<0
B. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
C. 不能用玻璃瓶来盛装氟化钠水溶液
D. 常温下Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。请回答下列问题:
(1)为提高“酸溶”时镍元素的浸出率,所采取的的措施为____(写1种)。
(2)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为_______。
(3)“氨解”的目的为__ “氨解”时需要控制低温原因是______。
(4)“氧化”时发生反应的化学方程式为_____。
(5)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于_____。(已知:Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(6)若在流程中完成“系列操作”。则下列实验操作中,不需要的是____(填下列各项中序号)。




查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液A、B的pH与溶液体积(V)的关系如下图所示:

(1)稀释前起始浓度大小关系:c(A)_____c(B)(填“>”、“<”、“=”)
(2)稀释前向两溶液中分别投入足量锌,开始放H2的速率A_______B,最终得H2体积 A______B。(填“<”“>”“=”)
(3)若使稀释后所得两溶液的pH重新相等,加水量_____________多。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如右图所示,下列说法正确的是
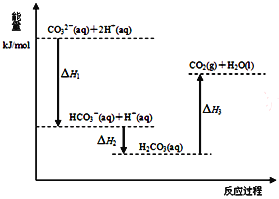
A. 反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)为放热反应
B. H1>H2 H2<H3
C. CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) H=(H1+H2+H3)
D. H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则H3变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+I2(g)===
(g)+I2(g)===![]() (g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
(g)+2HI(g),起始总压为105 Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数Kp=________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
②环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是________(填标号)。

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
(2) 298 K时,将20 mL 3x mol·L-1Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO33- (aq)+I2(aq)+2OH-(aq)![]() AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。

下列可判断反应达到平衡状态的是________(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO33-)
c.  不再变化
不再变化
d.c(I-)=y mol·L-1
(3)已知反应2HI(g) ![]() H2(g)+I2(g),ΔH>0,由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。
H2(g)+I2(g),ΔH>0,由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()

A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大B. 平衡向正反应方向移动
C. D的体积分数变大D. a<c+d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com