
【题目】为了研究物质的性质和用途,需要对物质进行分离与提纯。根据下列信息回答问题。
(1)要从氯化钠和纯碱的混合物中分离出纯碱晶体可采取的方法是_______(填代号)
a.溶解,过滤 b. 溶解,蒸发结晶,过滤 c. 溶解,蒸发浓缩,降温结晶

(2)某同学设计的分离CO2和CO混合气体的实验。装置如图所示:

关闭b,打开a,混合气体通过该装置时,先得到的气体是_________,然后进行的操作是________________________,得到的气体是_________。
【答案】c CO 关闭a,打开b CO2
【解析】
(1)物质在同一溶剂中的溶解度不同,在饱和情况下,通过改变溶液温度而使其中的一种物质结晶析出,达到分离的效果。
(2)关闭b,打开a,氢氧化钠与二氧化碳反应,可得到CO气体,然后关闭a,打开b,硫酸与碳酸钠反应生成二氧化碳气体。
(1)由图可知,氯化钠溶解度受温度影响较小,碳酸钠溶解度受温度影响大,利用冷却热饱和溶液分离,即用热水把固体溶解配制成饱和溶液,等液体冷却后,因为碳酸钠的溶解度随温度变化大,而NaCl小,所以碳酸钠析出,而氯化钠留在母液当中,反复多次也可以提纯,故可用“溶解、冷却结晶、过滤”的方法分离,故答案为:c;
(2)关闭b,打开a,氢氧化钠与二氧化碳反应,可得到CO气体,然后关闭a,打开b,硫酸与碳酸钠反应生成CO2气体。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:①称取ng草酸晶体配成100.00mL水溶液;②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为amol·L-1的KMnO4溶液滴定,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。反应生成MnSO4在水溶液中基本无色,试回答下列问题:
(1)实验台上有以下仪器,实验中不需要的是___(填序号)。
a.托盘天平(带砝码、镊子) b.滴定管 c.100 mL容量瓶 d.烧杯 e.漏斗 f.锥形瓶 g.玻璃棒 h.药匙 i.烧瓶
(2)实验中KMnO4溶液应装在___式滴定管中,原因是___。
(3)滴定过程中用去VmLamol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为__mol·L-1,由此可计算x的值为___。
(4)若滴定终点读数时俯视,则计算出的x值可能__(填偏大、偏小、无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,V升容器中加入a mol HI使之分解:2HI(g) ![]() H2(g)+I2(g),反应达到平衡状态后,下列推测正确的是( )
H2(g)+I2(g),反应达到平衡状态后,下列推测正确的是( )
A. 减压时,v(逆)增大,v(正)减小,平衡向逆反应方向移动
B. 若加入2a mol HI,则平衡常数变为2倍
C. 加压时,v(逆)、v(正)均不变,平衡不移动
D. 若保持压强不变,通入氦气,则v(逆)、v(正)均减小,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:①![]()
②![]()
③![]()
试据此写出一氧化碳燃烧的热化学方程式___________________________。
Ⅱ.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
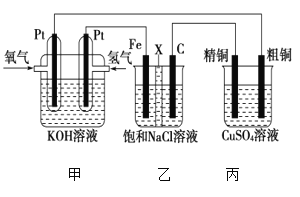
①石墨电极为________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液先变红。乙池中电解总方程式为____________。
②如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,溶液中硫酸铜浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为______________________。
③若在标准状况下,有224 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状况下体积为________mL;丙装置中阴极析出铜的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56gCu和200mL某浓度的浓HNO3混合,随着反应的进行生成气体的颜色逐渐变浅,当Cu反应完全时,共收集到气体1.12L(标准状况)。
下列关于该反应的分析错误的是( )
A.该反应生成的NO2与NO的体积比为7 : 3
B.该反应转移电子数为0.04NA
C.该反应消耗HNO3的物质的量为0.13mol
D.反应结束后所得溶液中(忽略反应前后溶液体积的变化)c(NO3-) = 0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)与H2(g)在一定条件下反应生成NH3(g),过程如下图,下列说法正确的是
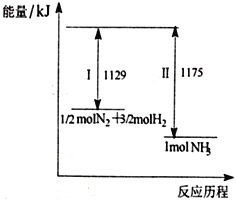
A. I为放热过程、Ⅱ为吸热过程
B. 1/2 molN2和3/2molH2的键能之和大于1 mol NH3的键能
C. 1/2molN2和3/2molH2所具有的能量之和低于1 mol NH3所具有的能量
D. 该过程的热化学反应方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 强酸跟强碱的反应热一定是中和热
B. 1molC完全燃烧放热383.3kJ,其热化学方程为:C+O2=CO2ΔH=-383.3kJ·mol-1
C. 在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热叫做中和热
D. 表示中和热的离子方程式为:H+(aq)+OH-(aq)![]() H2O(l);ΔH=57.3KJ·mol-1
H2O(l);ΔH=57.3KJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0
B. △H2>0,△H4>0
C. △H1=△H2+△H3
D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,近年来我国着力推进绿色发展、循环发展等,形成节约资源和环境保护的空间格局。
Ⅰ.为了寻求对环境无污染燃料燃烧法,有人曾研究了在标准条件下氮的氧化物与碳的氧化物相互作用的机理。
(1)确定该反应的反应过程如下:
第一步:NO2(g)+CO(g)→O—N…O…C…O—O △H=+134kJ/mol
第二步:O—N…O…C—O→NO(g)+CO2(g) △H=-368kJ/mol
总反应式:NO2(g)+CO(g)→NO(g)+CO2(g) △H=___kJ/mol
(2)对于任意一个化学反应,通过实验可以确定其反应速率与反应物浓度的定量关系:γ=kcm(NO2)·cn(CO),该方程称为速率方程,其中k称为速率常数。分析表中数据,写出该反应的速率方程表达式:___。

II.活性炭也可处理大气污染物NO,其原理:2NO(g)+C(s)![]() CO2(g)+N2(g) △H>0。在T℃时,在容积一定的刚性容器中加入NO气体和活性炭粉,使之发生反应测得各物质的物质的量如下:
CO2(g)+N2(g) △H>0。在T℃时,在容积一定的刚性容器中加入NO气体和活性炭粉,使之发生反应测得各物质的物质的量如下:
![]()
(3)计算T℃时,该反应的平衡常数K=___。
(4)为了提高NO的转化率和反应速率,可采取的措施有___(填字母)。
A.增加NO的用量 B.增加活性炭的用量
C.升高温度 D.增大体系压强
Ⅲ.用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示。

(5)电极I电极反应式为___。
(6)电解时H+的移动方向___(填“从左向右”、“从右向左”或“不移动”)
(7)标况下,每处理1molNO的同时,可产生O2的体积___L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com