
【题目】“绿水青山就是金山银山”,近年来我国着力推进绿色发展、循环发展等,形成节约资源和环境保护的空间格局。
Ⅰ.为了寻求对环境无污染燃料燃烧法,有人曾研究了在标准条件下氮的氧化物与碳的氧化物相互作用的机理。
(1)确定该反应的反应过程如下:
第一步:NO2(g)+CO(g)→O—N…O…C…O—O △H=+134kJ/mol
第二步:O—N…O…C—O→NO(g)+CO2(g) △H=-368kJ/mol
总反应式:NO2(g)+CO(g)→NO(g)+CO2(g) △H=___kJ/mol
(2)对于任意一个化学反应,通过实验可以确定其反应速率与反应物浓度的定量关系:γ=kcm(NO2)·cn(CO),该方程称为速率方程,其中k称为速率常数。分析表中数据,写出该反应的速率方程表达式:___。

II.活性炭也可处理大气污染物NO,其原理:2NO(g)+C(s)![]() CO2(g)+N2(g) △H>0。在T℃时,在容积一定的刚性容器中加入NO气体和活性炭粉,使之发生反应测得各物质的物质的量如下:
CO2(g)+N2(g) △H>0。在T℃时,在容积一定的刚性容器中加入NO气体和活性炭粉,使之发生反应测得各物质的物质的量如下:
![]()
(3)计算T℃时,该反应的平衡常数K=___。
(4)为了提高NO的转化率和反应速率,可采取的措施有___(填字母)。
A.增加NO的用量 B.增加活性炭的用量
C.升高温度 D.增大体系压强
Ⅲ.用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示。

(5)电极I电极反应式为___。
(6)电解时H+的移动方向___(填“从左向右”、“从右向左”或“不移动”)
(7)标况下,每处理1molNO的同时,可产生O2的体积___L。
【答案】-234 γ=4.0×10-3·c2(NO2) ![]() C 2HSO3-+2e-+2H+=S2O42-+2H2O 从右向左 11.2
C 2HSO3-+2e-+2H+=S2O42-+2H2O 从右向左 11.2
【解析】
(1)根据盖斯定律,将第一步反应+第二步反应计算;
(2)根据实验2、3知,CO(g)的浓度变成原来的2倍,反应速率不变,说明该反应速率与c(CO)无关;根据实验1、2或3、4知,NO2(g)浓度变成原来的2倍,反应速率变成原来的4倍,因此反应速率与c2(NO2)成正比,结合实验数据计算解答;
(3)假设容器的体积为VL,根据表格数据,平衡时,c(NO)=![]() mol/L,c(N2)=
mol/L,c(N2)=![]() mol/L,c(CO2)=
mol/L,c(CO2)=![]() mol/L,据此计算该反应的平衡常数K;
mol/L,据此计算该反应的平衡常数K;
(4)根据温度、压强和浓度对反应速率和化学平衡的影响分析判断;
(5)HSO3-在电极I上转化为S2O42-,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,则电极Ⅱ为阳极,电解池中阳离子向阴极移动,结合电解池原理和得失电子守恒分析解答(5)~(7)。
(1)第一步:NO2(g)+CO(g)→O—N…O…C…O—O △H=+134kJ/mol,第二步:O—N…O…C—O→NO(g)+CO2(g) △H=-368kJ/mol,根据盖斯定律,将第一步反应+第二步反应得:NO2(g)+CO(g)→NO(g)+CO2(g) △H=(+134kJ/mol)+(-368kJ/mol)=-234kJ/mol,故答案为:-234;
(2)根据实验2、3知,CO(g)的浓度变成原来的2倍,反应速率不变,说明该反应速率与c(CO)无关;根据实验1、2或3、4知,NO2(g)浓度变成原来的2倍,反应速率变成原来的4倍,因此反应速率与c2(NO2)成正比;则γ=kc2(NO2),将实验2的数据代入,得到k=4.0×10-3,因此γ=4.0×10-3·c2(NO2),故答案为:γ=4.0×10-3·c2(NO2);
(3)假设容器的体积为VL,根据表格数据,平衡时,c(NO)=![]() mol/L,c(N2)=
mol/L,c(N2)=![]() mol/L,c(CO2)=
mol/L,c(CO2)=![]() mol/L,该反应的平衡常数K=
mol/L,该反应的平衡常数K=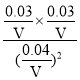 =
=![]() ,故答案为:
,故答案为:![]() ;
;
(4)A.增加NO的用量,NO的转化率降低,错误;B.增加活性炭的用量,不能改变平衡的移动和增大化学反应速率,错误;
C.升高温度,反应速率加快,平衡正向移动,NO的转化率增大,正确;D.增大体系压强,该平衡不移动,不能增大NO的转化率,错误;故答案为:C;
(5)根据图示,HSO3-在电极I上转化为S2O42-,过程中S的化合价降低,得到电子发生还原反应,则电极I为阴极,电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O,故答案为:2HSO3-+2e-+2H+═S2O42-+2H2O;
(6)电极I
(7)电极Ⅱ为阳极,H2O在电极Ⅱ上被转化为O2,发生电极反应:2H2O-4e-═O2↑+4H+,每处理1 mol NO转化生成0.5molN2,则转移电子数为1mol×2=2mol,根据电子转移守恒,则产生O2的物质的量为2mol×![]() =0.5mol,在标准状况下的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2。
=0.5mol,在标准状况下的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为了研究物质的性质和用途,需要对物质进行分离与提纯。根据下列信息回答问题。
(1)要从氯化钠和纯碱的混合物中分离出纯碱晶体可采取的方法是_______(填代号)
a.溶解,过滤 b. 溶解,蒸发结晶,过滤 c. 溶解,蒸发浓缩,降温结晶

(2)某同学设计的分离CO2和CO混合气体的实验。装置如图所示:

关闭b,打开a,混合气体通过该装置时,先得到的气体是_________,然后进行的操作是________________________,得到的气体是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(Cu2S,含有SiO2和少量Fe2O3等杂质)为原料制备碱式碳酸铜的流程如图所示:

已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:

②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有___(任写一种)。
(2)滤渣I经CS2提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是___(填化学式)。回收淡黄色副产品过程中温度控制在50~60℃之间,不宜过高或过低的原因是___。
(3)常温下“除铁”时加入的试剂A可用CuO,调节pH的范围为___,若加A后将溶液的pH调为5,则溶液中Fe3+的浓度为___ mol/L。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:___。
(5)“赶氨”时,最适宜的操作方法是___。
(6)测定副产品MnSO4·H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为___(保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是

A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作、现象所得出的结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 向氯水中滴加硝酸酸化的AgNO3溶液 | 产生白色沉淀 | 氯水中含有Cl﹣ |
B | 向某溶液中滴加盐酸 | 有无色气体产生 | 溶液中一定有CO32﹣ |
C | 向某溶液中加入烧碱溶液后加热,用湿润的红色石蕊试纸检验 | 石蕊试纸变蓝 | 溶液中有NH4+ |
D | 将SO2通入到酸性KMnO4溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”已成为各地的标牌。
(1)硫酸工业排出的尾气(主要含SO2)有多种处理方式
①下列物质中可以吸收硫酸工业尾气的是___
a.饱和Na2SO3溶液 b.饱和NaCl溶液 c.稀H2SO4 d.浓氨水
②硫酸工业排出的尾气也可用软锰矿浆(主要成分为MnO2)吸收,生成MnSO4,写出反应的化学方程式___。
(2)治理汽车尾气中NO和CO的方法之一是在汽车的排气管上装一个催化转化装置,使NO和CO在催化剂作用下转化为无毒物质。写出该反应的化学方程式:___。
(3)用NaOH溶液亦可以吸收废气中的氮氧化物,化学方程式如下NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O
①上述两反应中分别消耗等量的NO2时,转移电子的物质的量之比为___。
②标准状况下5.6L混合气体(只有NO、NO2)被0.5molL﹣1NaOH溶液完全吸收,至少需要NaOH溶液的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g)![]() Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
已知:CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸;Fe(CO)5熔点-20℃,沸点103℃。

回答下列问题:
(1)装置A中发生反应的化学方程式为__。
(2)装置C用于合成Ni(CO)4夹持装置略,最适宜选用的装置为__(填标号)。

(3)实验过程中为了防止__,必须先观察__。
(4)制得的Ni(CO)4中常溶有Fe(CO)5等杂质,提纯的方法是__(填标号)。
A.分液 B.蒸馏 C.过滤 D.重结晶
(5)利用“封管实验”原理可获得高纯镍。如图所示的石英玻璃封管中充有CO气体,则高纯镍粉在封管的__温度区域端生成(填“323K”或“473K”)。

(6)实验中加入11.50gHCOOH,C装置质量减轻2.95g设杂质不参加反应 ,E装置中盛有PdCl2溶液100mL,则PdCl2溶液的物质的量浓度至少为__molL-1(填实验现象再加热C装置)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlCl3是一种催化剂,某校学习小组用下面装置制备少量AlCl3.已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题
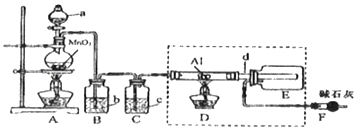
(1)仪器a中所装试剂名称为_____。
(2)B装置的作用为_____。
(3)能否省去C装置_____(填“能”或“否”),理由是_____(用化学方程式表示)。
(4)所用d导管较粗的原因是_____。
(5)F中碱石灰的作用为_____(填字母)。
a.吸收Cl2 b.吸收HCl c.吸收CO2 d.吸收H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com