
【题目】(1)现有下列4种物质:①NO、②Cl2、③浓H2SO4、④NH4HCO3。其中,受热易分解的是______________;(填序号,下同);可作氧气干燥剂的是______________;属于氧化物的是______________。
(2)选择装置,完成实验。
|
|
|
A | B | C |
①用CCl4萃取碘水中的I2,选用_________________(填序号,下同)。
②配制100 mL 0.50 mol/L NaOH溶液,选用_________________。
③从NaCl溶液中获取NaCl固体,选用____________________。
【答案】④ ③ ① A B C
【解析】
(1)根据物质的组成和性质分析①NO属于氧化物;② Cl2是单质;③浓H2SO4可作干燥剂,能够干燥H2、O2等气体;④NH4HCO3属于铵盐,受热易分解;
(2)根据仪器装置A装置用于萃取分液;B装置是容量瓶,用于配制一定物质的量浓度的溶液;C装置是蒸发装置,用于蒸发。
(1)根据以上①NO、②Cl2、③浓H2SO4、④NH4HCO3四种物质中,受热易分解的是④;可作氧气干燥剂的是③;属于氧化物的是①;
故答案为:④ ;③ ;①;
(2)根据以上分析①用CCl4萃取碘水中的I2,是萃取分液操作,故选用装置A;
②配制100 mL 0.50 mol/L NaOH溶液,要用100mL的容量瓶,故选用装置B;
③从NaCl溶液中获取NaCl固体,采用蒸发溶剂的方法,故选用装置C。
故答案为:A ;B;C。


科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:

已知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS、CuO和SiO2等);
Ⅱ.浸出液主要含盐酸和SbCl3,还含SbCl2、CuCl2、AsCl3和PbCl2等杂质;
Ⅲ.常温下,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(1)NaH2PO2中P的化合价为___________。
(2)“酸浸”过程中SbCl3和Sb2S3反应有S生成,该反应的还原产物是___________(填化学式)。
(3)写出“还原”反应的化学方程式:_________________________________。
(4)已知:浸出液中C(Cu2+)=0.01mo/L、C(Pb2+)=0.1mo/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是______________________(填化学式);当CuS、PbS共沉时,![]() ___________。
___________。
(5)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂还原剂的物质的量之比为_______。常温下,SbCl2溶液的pH<7,用离子方程式表示其原因:_____________________。
(6)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______________________;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为正值
B. 恒温恒容下,通入N2,压强增大,反应速率加快
C. 升高温度,正反应速率加快,逆反应速率减慢,平衡正向移动
D. 该反应化学方程式为CO+H2O![]() CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示的实验装置研究气体X的性质。气体X的主要成分是氯气,其中还含有水蒸气。请回答下列问题:
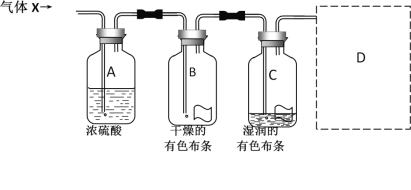
(1)该实验的主要目的是__________________________。
(2)与实验目的直接相关的实验现象是_________________________。
(3)图中所示的实验设计还存在不足。请根据相关物质的性质,在图中的D处画图补充有关实验装置和所用试剂。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为

A. 7∶2
B. 5∶4
C. 3∶5
D. 2∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
A. ②④ B. ①③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时,0.01 mol/L NaOH溶液的pH=11,0.1 mol/L的HA溶液中c(H+)/c(OH-)=109
请回答下列问题:
(1)该温度下,水的离子积Kw=_____,0.1 mol/L的HA溶液中水电离出的c(OH-)=_____。
(2)在室温下,将pH之和为14的NaOH溶液和HA溶液等体积混合后,所得溶液呈_____(填“酸”“碱”或“中”)性。
(3)在室温下,蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是_____。
A.水的电离程度 B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值
(4)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:
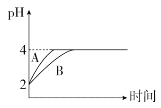
①图中表示HA溶液pH变化曲线的是____(填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1_____m2(填“>”“<”或“=”)。
(5)室温下,取0.01 mol/L的盐酸和HA溶液各100 mL,分别滴加0.01 mol/LNaOH溶液至恰好完全反应,所需NaOH溶液的体积前者____后者(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 1 mol Na2O2晶体中共含有4NA个离子
B. 标准状况下,22.4LCH3OH含有NA个分子
C. 常温下,1LpH=1的H2SO4溶液中,含有0.2NA个H+
D. 标准状况下,22.4LN2和O2的混合气体中含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2),无色液体,电离类似于氨:NH3+H2O![]() NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是
NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是

A. 曲线Ⅱ代表的微粒符号为H2NCH2CH2NH3+
B. 曲线Ⅰ与曲线II相交点对应pH=6.85
C. 0.1 mol ·L-1H2NCH2CH2NH3Cl溶液中各离子浓度大小关系为c(Cl-)>c(H2NCH2CH2NH3+)>c(H+)>c(OH-)
D. 乙二胺在水溶液中第二步电离的方程式H2NCH2CH2NH3++H2O![]() [H3NCH2CH2NH3]2++OH-
[H3NCH2CH2NH3]2++OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com