
【题目】NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 1 mol Na2O2晶体中共含有4NA个离子
B. 标准状况下,22.4LCH3OH含有NA个分子
C. 常温下,1LpH=1的H2SO4溶液中,含有0.2NA个H+
D. 标准状况下,22.4LN2和O2的混合气体中含有的原子数为2NA
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以羟磷灰石精矿[主要成分是Ca5(PO4)3OH,还含有少量石英和氧化铁等杂质]为原料,生产磷酸二氢钾的流程如下:

(1)“制酸”过程中生成磷酸的化学方程式为___________________________________________________。
该过程若用硫酸代替盐酸,磷酸的产率明显降低,其原因是___________________________________。
(2)“反应”中加入有机碱——三辛胺(TOA)的目的是____________________________________________。
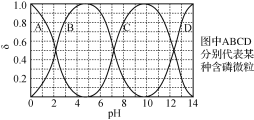
(3)“反应”中,三辛胺的用量会影响溶液的pH。水溶液中H3PO4、H2PO4-、HPO42-、PO43-的分布分数δ随pH的变化如右图所示。
①“反应”中,当pH=____时,停止加入三辛胺。
②使用pH试纸测定溶液pH的操作是_____________________________________________。
(4)查阅资料可知:①磷酸三丁酯、二(2乙基己基)磷酸都是难溶于水的液态有机物。
②磷酸三丁酯对H3PO4和Fe3+有较强的萃取作用。
③二(2乙基己基)磷酸仅对Fe3+有较强的萃取作用。
请根据题中信息,补充完整“提纯”步骤的实验方案:向“制酸”所得粗磷酸中加入活性炭,________________,向有机层中加入蒸馏水,振荡、静置,分液取水层,得到稀磷酸。[实验中须使用的试剂有:二(2乙基己基)磷酸、磷酸三丁酯]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列4种物质:①NO、②Cl2、③浓H2SO4、④NH4HCO3。其中,受热易分解的是______________;(填序号,下同);可作氧气干燥剂的是______________;属于氧化物的是______________。
(2)选择装置,完成实验。
|
|
|
A | B | C |
①用CCl4萃取碘水中的I2,选用_________________(填序号,下同)。
②配制100 mL 0.50 mol/L NaOH溶液,选用_________________。
③从NaCl溶液中获取NaCl固体,选用____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol N2O4气体充入容积为10L的密闭容器中,回答下列问题:

(1)100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为________________;反应N2O4(g)![]() 2NO2(g)的平衡常数K为___________。
2NO2(g)的平衡常数K为___________。
(2)当反应达到平衡时,对于反应N2O4(g)![]() 2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是____________。
2NO2(g),改变某一条件后,下列说法中,一定能说明化学平衡向正反应方向移动的是____________。
①气体颜色加深
②N2O4的体积分数增加
③恒温恒压充入He
④单位时间内消耗N2O4和NO2的物质的量之比等于1:2
(3)若起始时充入1molNO2气体,建立如下平衡2NO2(g)![]() N2O4(g),测得NO2的转化率为a%,在温度、体积不变时,再充入1molNO2气体,重新达到平衡时,测得NO2的转化率为b%,则a______b(填“>”、“<”或“=”);若恒温恒压时,充入1molNO2气体,反应2NO2(g)
N2O4(g),测得NO2的转化率为a%,在温度、体积不变时,再充入1molNO2气体,重新达到平衡时,测得NO2的转化率为b%,则a______b(填“>”、“<”或“=”);若恒温恒压时,充入1molNO2气体,反应2NO2(g)![]() N2O4(g)达到平衡后,再向容器内通入一定量的NO2气体,重新达到平衡时,NO2的体积分数_________(填“不变”、“增大”或“减小”)。
N2O4(g)达到平衡后,再向容器内通入一定量的NO2气体,重新达到平衡时,NO2的体积分数_________(填“不变”、“增大”或“减小”)。
(4)如下图a所示,连通的玻璃瓶中充入NO2气体,建立如下平衡2NO2(g)![]() N2O4(g),已知Fe3+对H2O2的分解具有催化作用,根据图b、c中的信息,推测A瓶中气体颜色比B瓶中的____________(填“深”或“浅”)。
N2O4(g),已知Fe3+对H2O2的分解具有催化作用,根据图b、c中的信息,推测A瓶中气体颜色比B瓶中的____________(填“深”或“浅”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B. Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C. TiCl4+(x+2)H2O(过量) ![]() TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
D. SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向20mL含0.10mol·L-1Cr2+和0.10mol·L-1Fe2+的混合溶液中滴加0.10 mol·L -1NaOH溶液,金属阳离子浓度与滴入NaOH溶液体积的关系曲线如图所示。若溶液中金属离子浓度小于10-5mol·L-1视为完全沉淀,则下列说法错误的是
[Cr(OH)2的ksp为2×10-16,Fe(OH)2的ksp为8×10-16]

A. 曲线A表示c(Fe2+)
B. 当V(NaOH)=30mL时,Fe2+开始沉淀
C. 当pH=7时溶液中Fe2+、Cr2+均完全沉淀
D. V(NaOH)>30mL时,溶液中c(Fe2+)︰c(Cr2+) =4.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
①称取w g草酸晶体,配成100.00mL水溶液。
②量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。
③用浓度为a mol·L1的KMnO4溶液滴定到滴入最后一滴KMnO4半分钟后不再褪色为止。
所发生反应:KMnO4+H2C2O4+H2SO4——K2SO4+CO2↑+MnSO4+H2O(未配平)。
试回答:
(1)实验中不需要的仪器有_____(填序号),还缺少的仪器有_____。
a.托盘天平(带砝码,镊子);b.滴定管;c.100 mL量筒;d.滴定管夹;e.烧杯;f.漏斗;g.锥形瓶;h.玻璃棒;i.药匙;f铁架台。
(2)实验中,标准液KMnO4溶液应装在_________式滴定管中。
(3)误差讨论:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会_____(填“偏大”“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会_____。
(4)在滴定过程中若用a mol·L1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为_________mol·L1,由此可计算x值是_________。(用代数式表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨甲环酸(G),别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略):

回答下列问题:
(1)A的结构简式是___________。
(2)C的化学名称是___________。
(3)②的反应类型是___________。
(4)E中不含N原子的官能团名称为___________。
(5)氨甲环酸(G)的分子式为___________。
(6)写出满足以下条件的所有E的同分异构体的结构简式:______________________。
a含苯环 b.与硝化甘油具有相同官能团 c.核磁共振氢谱有三组峰
(7)写出以![]() 和
和 为原料,制备医药中间体
为原料,制备医药中间体 的合成路线:_______________________________________________________(无机试剂任选)。
的合成路线:_______________________________________________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸普鲁卡因是外科常用药,化学名:对![]() 氨基苯甲酸
氨基苯甲酸![]() 二乙胺基乙酯盐酸盐,其结构为:
二乙胺基乙酯盐酸盐,其结构为:![]() ,作为局部麻醉剂,普鲁卡因在传导麻醉,浸润麻醉及封闭疗法中均有良好药效。它的合成路线如下:
,作为局部麻醉剂,普鲁卡因在传导麻醉,浸润麻醉及封闭疗法中均有良好药效。它的合成路线如下:

已知:
i甲基为邻对位定位基,使后续基团进入邻对位;羧基为间位定位基,使后续基团进入间位。
ii![]()
(1)A的分子式为C2H4O,核磁共振氢谱中只含有一个峰,请写出A的结构简式______。
(2)写出D中所含有的官能团名称______。
(3)写出反应![]() 的试剂和条件______,反应①与②的顺序是否可以颠倒______
的试剂和条件______,反应①与②的顺序是否可以颠倒______![]() 填“是”或“否”
填“是”或“否”![]() ,原因是______。
,原因是______。
(4)由C到D的反应类型为______。
(5)写出B、D反应生成E的方程式______。
(6)M在组成上比C多1个-CH2-原子团,其结构满足下列条件的同分异构体有______种。
①含有苯环②属于氨基酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com