
【题目】磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以羟磷灰石精矿[主要成分是Ca5(PO4)3OH,还含有少量石英和氧化铁等杂质]为原料,生产磷酸二氢钾的流程如下:

(1)“制酸”过程中生成磷酸的化学方程式为___________________________________________________。
该过程若用硫酸代替盐酸,磷酸的产率明显降低,其原因是___________________________________。
(2)“反应”中加入有机碱——三辛胺(TOA)的目的是____________________________________________。
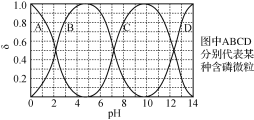
(3)“反应”中,三辛胺的用量会影响溶液的pH。水溶液中H3PO4、H2PO4-、HPO42-、PO43-的分布分数δ随pH的变化如右图所示。
①“反应”中,当pH=____时,停止加入三辛胺。
②使用pH试纸测定溶液pH的操作是_____________________________________________。
(4)查阅资料可知:①磷酸三丁酯、二(2乙基己基)磷酸都是难溶于水的液态有机物。
②磷酸三丁酯对H3PO4和Fe3+有较强的萃取作用。
③二(2乙基己基)磷酸仅对Fe3+有较强的萃取作用。
请根据题中信息,补充完整“提纯”步骤的实验方案:向“制酸”所得粗磷酸中加入活性炭,________________,向有机层中加入蒸馏水,振荡、静置,分液取水层,得到稀磷酸。[实验中须使用的试剂有:二(2乙基己基)磷酸、磷酸三丁酯]
【答案】Ca5(PO4)3OH+10HCl===5CaCl2+3H3PO4+H2O 使用H2SO4,会产生微溶性的CaSO4覆盖在羟磷灰石的表面,阻止反应的继续进行 加入三辛胺会与溶液中的HCl反应,促进了KH2PO4生成 4.5 用洁净的玻璃棒蘸取溶液滴在pH试纸上,立即与标准比色卡对比,读取pH 过滤,向滤液中加入适量二(2乙基己基)磷酸,振荡、静置,分液取水层;在水层中加入适量磷酸三丁酯,振荡,静置,分液取有机层
【解析】
(1)“制酸”过程中羟磷灰石精矿与盐酸反应生成磷酸、氯化钙和水,反应的化学方程式为Ca5(PO4)3OH+10HCl=5CaCl2+3H3PO4+H2O;
该过程若用硫酸代替盐酸,会产生微溶性的CaSO4覆盖在羟磷灰石的表面,阻止反应的继续进行,使磷酸的产率明显降低;
(2)“反应”中加入有机碱——三辛胺(TOA)会与溶液中的HCl反应,促进了KH2PO4生成;
(3)①“反应”中,三辛胺的用量会影响溶液的pH。三辛胺(TOA)会与溶液中的HCl反应,促进了KH2PO4生成,当pH=4.5时,c(H2PO4-)最大,故“反应”中,当pH=4.5时,停止加入三辛胺;
②使用pH试纸测定溶液pH的操作是用洁净的玻璃棒蘸取溶液滴在pH试纸上,立即与标准比色卡对比,读取pH;
(4)“提纯”步骤的实验方案:向“制酸”所得粗磷酸中加入活性炭,过滤,向滤液中加入适量二(2乙基己基)磷酸,振荡、静置,分液取水层;在水层中加入适量磷酸三丁酯,振荡,静置,分液取有机层,向有机层中加入蒸馏水,振荡、静置,分液取水层,得到稀磷酸。


科目:高中化学 来源: 题型:
【题目】下列各组物质中,按熔点由低到高的顺序排列正确的是
A. C12、Br2、I2B. CO2、SiO2 、KCl
C. O2、I2、HgD. 金刚石、NaCl、SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:

已知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS、CuO和SiO2等);
Ⅱ.浸出液主要含盐酸和SbCl3,还含SbCl2、CuCl2、AsCl3和PbCl2等杂质;
Ⅲ.常温下,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(1)NaH2PO2中P的化合价为___________。
(2)“酸浸”过程中SbCl3和Sb2S3反应有S生成,该反应的还原产物是___________(填化学式)。
(3)写出“还原”反应的化学方程式:_________________________________。
(4)已知:浸出液中C(Cu2+)=0.01mo/L、C(Pb2+)=0.1mo/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是______________________(填化学式);当CuS、PbS共沉时,![]() ___________。
___________。
(5)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂还原剂的物质的量之比为_______。常温下,SbCl2溶液的pH<7,用离子方程式表示其原因:_____________________。
(6)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______________________;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

(1)操作①的名称是_____,操作②的名称是____。
(2)试剂a是_____(填化学式,下同),试剂b是____,固体B是_____。
(3)加入试剂a所发生反应的化学方程式为_______________________。加入试剂b所发生反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随着能量的变化。下列过程中的能量变化不是由化学反应引起的是( )
A. 干冰升华B. 酸碱中和
C. 天然气燃烧D. Ba(OH)28H2O晶体与NH4Cl晶体混合并搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率等于b点
D. 图4表示同一温度下,相同物质的量BaO2在不同容积的容器中进行反应:2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为正值
B. 恒温恒容下,通入N2,压强增大,反应速率加快
C. 升高温度,正反应速率加快,逆反应速率减慢,平衡正向移动
D. 该反应化学方程式为CO+H2O![]() CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示的实验装置研究气体X的性质。气体X的主要成分是氯气,其中还含有水蒸气。请回答下列问题:
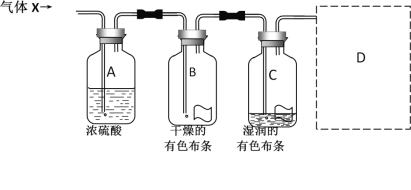
(1)该实验的主要目的是__________________________。
(2)与实验目的直接相关的实验现象是_________________________。
(3)图中所示的实验设计还存在不足。请根据相关物质的性质,在图中的D处画图补充有关实验装置和所用试剂。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 1 mol Na2O2晶体中共含有4NA个离子
B. 标准状况下,22.4LCH3OH含有NA个分子
C. 常温下,1LpH=1的H2SO4溶液中,含有0.2NA个H+
D. 标准状况下,22.4LN2和O2的混合气体中含有的原子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com