
【题目】下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O![]() HCO3-+OH- 热的纯碱溶液清洗油污
HCO3-+OH- 热的纯碱溶液清洗油污
B. Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C. TiCl4+(x+2)H2O(过量) ![]() TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
D. SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】化学反应伴随着能量的变化。下列过程中的能量变化不是由化学反应引起的是( )
A. 干冰升华B. 酸碱中和
C. 天然气燃烧D. Ba(OH)28H2O晶体与NH4Cl晶体混合并搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为

A. 7∶2
B. 5∶4
C. 3∶5
D. 2∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时,0.01 mol/L NaOH溶液的pH=11,0.1 mol/L的HA溶液中c(H+)/c(OH-)=109
请回答下列问题:
(1)该温度下,水的离子积Kw=_____,0.1 mol/L的HA溶液中水电离出的c(OH-)=_____。
(2)在室温下,将pH之和为14的NaOH溶液和HA溶液等体积混合后,所得溶液呈_____(填“酸”“碱”或“中”)性。
(3)在室温下,蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是_____。
A.水的电离程度 B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值
(4)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:
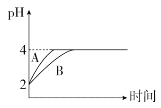
①图中表示HA溶液pH变化曲线的是____(填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1_____m2(填“>”“<”或“=”)。
(5)室温下,取0.01 mol/L的盐酸和HA溶液各100 mL,分别滴加0.01 mol/LNaOH溶液至恰好完全反应,所需NaOH溶液的体积前者____后者(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g·cm-3,则该盐酸的物的量浓度是( )mol·L-1
A. 1000ab/(22400+36.5a) B. ab/(22400+36.5a)
C. 1000ab/(22.4+36.5a) D. 1000ab/(22400+36.5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列叙述正确的是
A. 1 mol Na2O2晶体中共含有4NA个离子
B. 标准状况下,22.4LCH3OH含有NA个分子
C. 常温下,1LpH=1的H2SO4溶液中,含有0.2NA个H+
D. 标准状况下,22.4LN2和O2的混合气体中含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是两个实验小组分别进行“加热硫酸铜和氢氧化钠溶液反应后生成物”的实验过程示意图


甲组 乙组
(甲组)氢氧化钠与硫酸铜反应的化学方程式为___________,加热后产生黑色的氧化铜。
(乙组)为寻找实验中没有产生氧化铜的原因,他们进行了以下实验探究:
(查阅资料)在酸性条件下,氢氧化钠与硫酸铜在溶液中可发生如下反应:6NaOH+4CuSO4=3Na2SO4+Cu4(OH)6SO4↓,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
(提出猜想)根据资料分析,同学们针对试管中溶液呈酸性的原因做出了以下猜想:
猜想Ⅰ:硫酸铜溶液呈酸性 猜想Ⅱ:生成的硫酸钠使溶液呈酸性。
(实验与结论)
实验①:用pH试纸测定硫酸铜溶液的酸碱度,得出其pH______7(填“>”、“<”或“=”),硫酸铜溶液呈酸性,猜想Ⅰ成立。
实验②:向盛有硫酸钠溶液的试管中滴加石蕊溶液,观察到溶液显紫色,硫酸钠溶液呈______(填“酸”、“中”或“碱”)性,猜想Ⅱ不成立。
(交流与反思)(1)乙同学认真分析甲组实验后,一致认为不需要通过实验就能判断猜想Ⅱ不成立,理由是 _________。
(2)在化学反应中,相同的反应物因其质量比不同可能会导致生产物不同,请另举一例______(写出反应物即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________,其外围电子排布式为___________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是___________。
(3)配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为___________。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式___________;生成气体分子的中心原子杂化方式为___________。
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于___________,若该堆积方式下的晶胞参数为acm,则钴原子的半径为___________pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答:

(1)从氯化钾溶液中得到氯化钾固体,选择装置_____(填代表装置图的字母,下同),除去自来水中的Cl-等杂质,选择装置______。
(2)从碘水中分离出I2,选择装置______,该分离方法的名称为______。
(3)装置A中①的名称是_______。进水的方向是从______口进水。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com