
【题目】下列有关物质用途的说法正确的是
A. 碳酸钠用于治疗胃酸过多 B. 稀硫酸用于除铁锈
C. 晶体硅用于制造光导纤维 D. 硫酸钡用于制作石膏绷带
科目:高中化学 来源: 题型:
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ、自18世纪以来,科学家们不断探索。从局部到系统,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
序号 | ① | ② | ③ | ④ |
科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
上述科学家的研究按照时间先后排序合理的是__________(填数字序号)。
Ⅱ、1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
Ni=Co=59 | |||||
H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
C=12 | Si=28 | ?=70 | Sn=118 | ||
N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
O=16 | S=32 | Se=79.4 | Te=128? | ||
F=19 | Cl=35.5 | Br=80 | I=127 | ||
Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
Ca=40 | Pb=207 |
(1)门捷列夫将已有元素按照相对原子质量排序,同一__________(填“横行”或“纵列”)元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是__________,第5列方框中“Te=128?”的问号表达的含义是__________。
(2)20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是__________(填字母序号)。
A.随着核电荷数递增,子核外电子排布呈现周期性变化
B.随着核电荷数递增,原子半径呈现周期性变化
C.随着核电荷数递增,元素最高正化合价呈现周期性变化
Ⅲ、X、Y、Z、W、R是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为__________,元素Z的离子结构示意图为__________。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为__________。
(3)元素W位于周期表的第__________族,其非金属性比元素R弱,用原子结构的知识解释原因____________________。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式____________________。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代医学巨著《本草纲目》中记载了很多化学物质。下列选项所描述的物质在分类上不同于其它三种的是
A. “其状如水似银,故名水银。者,流动貌”
B. “绿矾新出窟未见风者,正如琉璃色,人以为石胆”
C. “石之津气,钟聚成乳,滴溜成石,故名石钟乳”
D. “石碱,出山东济宁诸处。彼人采蒿攀之属,……浣衣发面,甚获利也”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应。实验步骤及现象如下:
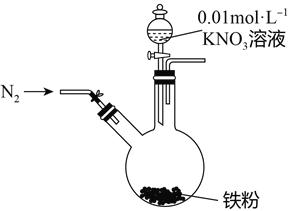
实验步骤 | 实验现象 |
1、打开弹簧夹,缓慢通入N2 | |
2、加入pH为2.5的0.01mol/L酸性KNO3溶液100mL | 铁粉部分溶解,溶液呈浅绿色; 铁粉不再溶解后,剩余铁粉表面出现少量白色物质附着。 |
3、反应停止后,拔掉橡胶塞,将圆底烧瓶取下 | 烧瓶内气体的颜色没有发生变化。 |
4、将剩余固体过滤 | 表面的白色物质变为红褐色。 |
(1)通入N2并保持后续反应均在N2氛围中进行的实验目的是______________________________。
(2)白色物质是__________,用化学方程式解释其变为红褐色的原因:____________________。
(3)为了探宄滤液的成分,该同学进一步设计了下述实验:
实验步骤 | 实验现象 |
1、取部分滤液于试管中,向其中加入KSCN溶液 | 溶液液无变化 |
2、将上述溶液分为两份,一份中滴入氯气;另一份中滴加稀硫酸 | 两份溶液均变为红色 |
3、另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸。 | 有气体生成,该气体使红色石蕊试纸变蓝。 |
(i)根据以上实验现象,可以判断滤液中存在____________________离子。
(ii)步骤2中滴加稀硫酸后溶液会由浅绿色变成红色,请用离子方程式解释其原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
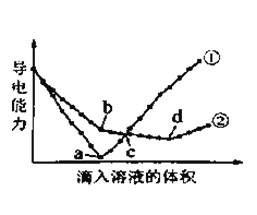
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. c点,两溶液中含有相同量的OH–
D. a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,若氯气与KOH恰好完全反应,产物中可能有KCl、KClO、KClO3,且c(Cl-)/c(ClO-)的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
A. 若某温度下,反应后c(Cl-)/c(ClO-)=11,则溶液中c(ClO-)/ c(ClO3-)=2: 1
B. 参加反应的氯气的物质的量等于a/2 mol
C. 改变温度,反应中转移电子的物质的量ne的范围:a/2mol≤ne≤5a/6 mol
D. 改变温度,产物中KClO3的最大理论产量为a/7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算
(1) 1mol HCl中含有HCl分子的个数是_______________________,1.204×1023个CH4分子的物质的量是____________mol。
(2)17克NH3的物质的量是 ______ mol,0.1mol H2O的质量是______________________g。
(3)标准状况下,11.2L O2的物质的量是 ______ mol ,1mol O2的体积是 ______ L。
(4)将8g NaOH配制成1L溶液,其物质的量浓度为_______________mol/L,1L 1mol/L NaOH溶液中含有溶质NaOH的质量是______________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com