
【题目】下列物质中的化学键,属于离子键的是( )
A. KClB. NH3C. CO2D. HCl
科目:高中化学 来源: 题型:
【题目】已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )
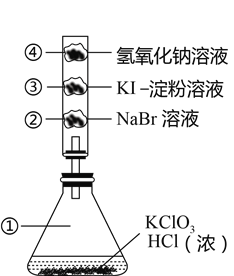
选项 | ① | ② | ③ | ④ |
A | 黄绿色 | 白色 | 紫色 | 白色 |
B | 黄绿色 | 橙色 | 紫色 | 黄绿色 |
C | 黄绿色 | 橙色 | 蓝色 | 白色 |
D | 黄绿色 | 橙色 | 蓝色 | 黄绿色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F原子序数依次增大.A的阳离子就是一个质子:B原子的最外层电子数是所在周期数的2倍;C、D在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体:E与A同一主族:F原子的K、L层电子数之和比K、M层电子数之和多l。A、D、E三种元素可形成化合物甲,B、D、E三种元素可形成化合物乙。请回答:
(1)C2的结构式为_______________。
(2)由上述元素组成的既含极性健又含非极性键的无机化合物分子的电子式为__________。
(3)A的单质与D的单质在强酸性条件下构成燃料电池,其正极反应式为__________。
(4)常温下,甲与乙的水溶液pH均为9,这两种溶液中由水电离出的OH-的物质的量浓度c(OH -)甲:c(OH-)乙= ________。
(5)将2.4gB的单质在足量D的单质中燃烧,所得气体通入1L 0.3mol/L的甲溶液中,完全吸收后,溶液中的溶质为______。溶液中所含离子的物质的量 浓度由大到小的顺序为______。
(6)由A、B、C、D四种元素组成的无机酸的酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是
A. 碳酸钠用于治疗胃酸过多 B. 稀硫酸用于除铁锈
C. 晶体硅用于制造光导纤维 D. 硫酸钡用于制作石膏绷带
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、方法和结论都正确的是
A. 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B. 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
C. 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体,说明该钾盐是![]()
D. 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解,部分Na2SO3被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是
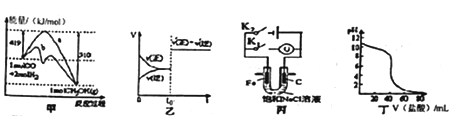
A. 图甲表示工业上用CO生产甲醇的反应CO(g)+2H2(g) ![]() CH3OH(g)。该反应的 △H=-91 kJ·mol-1
CH3OH(g)。该反应的 △H=-91 kJ·mol-1
B. 图乙表示己达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改 变的条件可能处加入催化剂
C. 图丙中若K1闭合,石墨棒周围液pH逐渐升高;若K2闭合,电路中通过0.002NA 个电子时,两极理论上共产生0.002mol气体
D. 图丁表示盐酸滴加0.1 mol·L-1NaOH溶液得到的滴定曲线,该实验的指示剂最好选取酚酞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应进行到一定程度会达到化学平衡状态,如K2Cr2O7溶液中存在平衡:Cr2![]() (橙色)+H2O
(橙色)+H2O![]() 2Cr
2Cr![]() (黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:
(黄色)+2H+。平衡时各种物质含量保持不变,达到一种相对的静止(如平衡时,每消耗1molH2O同时也会生成1molH2O)。外界条件改变时,平衡状态会被破坏而发生移动(如消耗的水多于生成的水,则平衡向正向移动),平衡移动符合勒夏特列原理,即如果改变可逆反应的条件(如浓度、压强、温度等),化学平衡就被破坏,并向减弱这种改变的方向移动。现在用K2Cr2O7溶液进行下列实验:

已知:C2H5OH遇到氧化剂容易被氧化。
结合实验,下列说法不正确的是 ( )
A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2![]() 被C2H5OH还原
被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性弱 D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和二氧化氮气体在室温下可以化合生成一种新的气态化合物A,为了测定A的组成进行以下实验,取Cl2、NO2混合气总体积5L,测定反应后所得气体体积随Cl2在原混合气体中所占体积分数x的变化而变化的规律.实验测知当Cl2所占体积分数为0.2或0.6时,反应后的总体积均为4L.
(1)通过分析和计算求得化合物A的化学式为_______________________________,发生反应的化学方程式_______________________________________________________.
(2)试讨论当x的取值范围不同时,反应后总体积V随x变化的函数关系_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用相关原理,回答下列各小题:
I.已知:NaHSO4在水中的电离方程式为NaHSO4=Na++H++SO42- .
(1)常温下,pH=5的NaHSO4溶液中水的电离程度______________(填“>”、”=”或“<”)pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为:______________(用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH![]() )______________c(SO42-)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______________7(填“>”、”=”或“<”)。
)______________c(SO42-)(填“>”、“=”或“<”);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______________7(填“>”、”=”或“<”)。
(3)将分别含有MnO![]() 、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有______________,一定不存在的是______________。
、Fe3+、Fe2+、I- 的四种溶液混合,调节溶液的pH,使pH=1,充分反应后:若I- 离子有剩余,上述四种离子在溶液中还存在的有______________,一定不存在的是______________。
II.在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为________________mol·L1,此时溶液中c(CrO42)等于______________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com