
常温下,pH=12的氨水中存在以下电离平衡:NH3·H2O NH4++OH-,
NH4++OH-,
往其中加入少量 0.01mol·L-1NaOH 溶液,保持不变的是
A.c(OH-) B.c(NH4+) C.c(NH3·H2O) D.c(NH4+)·c(OH-)
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
以铜为电极,a mol/L的硫酸铜溶液作电解液,对含有铁、锌、银的粗铜进行电解精炼,下列有关说法中正确的是( )
①粗铜应与电源的负极相连
②当有1 mol精铜析出时,就有2NA个电子通过电解质溶液
③阴极上的反应只有:Cu2++2e-===Cu
④电解结束时,c(CuSO4)<a mol/L
⑤杂质银以Ag2SO4形式沉入电解池形成“阳极泥”
A.②③ B.③④
C.①②④⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
请回答:
(1)写出A中反应的离子方程式 。
(2)B装置中所盛试剂是 ;E中烧杯内冷水的作用是 。
(3)实验前玻璃管之间连接需要用到橡皮管,其连接方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管中。
(4)检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。其中通入干燥CO2的目的是 。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过 (填实验名称)即可得到较纯净的PCl3。
(6)实验后关闭K1,打开K2,将A、B中余氯通入300ml 1mol/L的NaOH溶液中。若NaOH恰好完全反应,则吸收氯气的物质的量为(假设反应生成了NaCl 、 NaClO 和 NaClO3 等钠盐) mol,反应中转移电子的物质的量(n)的范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关问题,与盐的水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞 ⑤Al2S3不能通过溶液中的反应制取
A.①②③ B.②③④ C.①④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实中一定不能证明CH3COOH是弱电解质的是
①常温下某CH3COONa溶液的pH=8
②用CH3COOH溶液做导电实验,灯泡很暗
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④0.1 mol·L-1 CH3COOH溶液的pH=2.1
⑤CH3COONa和盐酸反应,生成CH3COOH
⑥0.1 mol·L-1的CH3COOH溶液稀释至100倍,pH<3
A.②⑤ B.② C.①③⑤ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲硅烷(SiH4)的结构与甲烷相似。SiH4分子为________分子(填极性或非极性),SiH4分子中H原子的1s轨道与Si原子的sp3轨道重叠形成Si—H_____ (填“σ键”或“π键”);甲硅烷能与硝酸银发生如下反应:
SiH4 + 8AgNO3 + 2H2O = 8 Ag↓ + SiO2↓ + 8HNO3
该反应中氢元素被氧化,则SiH4充当__________剂(填氧化或还原),由此可判断电负性:Si H(填“>”、“<”或“=”)

K$S5*U.CO¥M
(3)①一种含Cr的催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子的电子排布式为 。
②石墨晶体具有层状结构,质软、熔点高、能导电,其导电原理同金属晶体,则其导电的粒子是 (填“阳离子”、“阴离子”或“自由电子”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L恒容密闭容器中充入2 mol X和lmol Y发生反应: , 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
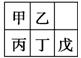
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,
下面判断正确的是
A.氢氧化物碱性:丙>丁>戊 B.金属性:甲>丙
C.原子半径: 丙<丁<戊 D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
第三周期元素X,它的原子核外最外层实现8个电子稳定结构所需电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍。则下列说法正确的是( )
A.X元素最高价氧化物的水化物一定是强酸
B.X元素的氢化物的化学式一定为H2X
C.X的单质一定是良好的半导体材料
D.X元素在常温下稳定存在的氧化物一定能与烧碱反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com