
【题目】设NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,2.24LH2O含有的分子数目为0.1NA
B.1mol/LCu(NO3)2溶液中NO3﹣的数目为2NA
C.2.4gMg转变成Mg2+失电子的数目为0.2NA
D.6.2gNa2O所含Na+的数目为0.1NA
科目:高中化学 来源: 题型:
【题目】化学社两位同学为探究铜跟浓硫酸的反应,设计了图所示装置. 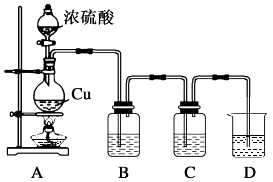
(1)反应开始前必须进行的操作是 .
(2)装置A中发生的反应的化学方程式为 .
(3)洗气瓶B中为品红溶液,确认有SO2生成的现象是 .
(4)洗气瓶C中为新制的氯水,反应的现象是新制氯水由淡黄绿色变为 , 原因是SO2具有性.
(5)烧杯D中盛装的试剂是浓度较大的溶液,其作用是
(6)若反应中有2mol电子转移,则生成的SO2在标准状况下的体积是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是生产多晶硅的主要原料.由粗硅制三氯氢硅的反应如下:
反应的热化学方程式 | 平衡常数(300℃) | |
主反应 | Si(s)+3HCl(g)SiHCl3(g)+H2(g)△H=﹣210kJmol﹣1 | K1(molL﹣1)﹣1 |
副反应 | Si(s)+4HCl(g)SiHCl4(g)+2H2(g)△H=﹣240kJmol﹣1 | K2(molL﹣1)﹣1 |
回答下列问题:
(1)写出SiHCl3的结构式 .
(2)SiHCl3 , 在NaOH溶液中剧烈反应放出H2 , 该反应的化学方程式为 .
(3)硅的平衡转化率与投料比 ![]() 的关系如图,则图中温度T1、T2、T3的大小顺序为 .
的关系如图,则图中温度T1、T2、T3的大小顺序为 . 
(4)平衡时, ![]() 的值a随着
的值a随着 ![]() 的值b的变化而变化.则
的值b的变化而变化.则 ![]() =(用含Kl、K2的代数式表示);根据关系式,工业上用H2适当稀释HCl来提高SiHCl3的纯度. 请用平衡移动原理加以解释 .
=(用含Kl、K2的代数式表示);根据关系式,工业上用H2适当稀释HCl来提高SiHCl3的纯度. 请用平衡移动原理加以解释 .
(5)也可用H2还原SiCl4来制取SiHCl3 . 300℃时该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(I)的变化曲线如图所示.据此判断:
①该反应的△H0(填“>”或“<”).
②在T2温度下,0﹣2s内的平均反应速率v(N2)=mol/(Ls).
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=﹣867kJmol﹣1
2NO2(g)═N2O4(g)△H=﹣56.9kJmol﹣1
写出CH4(g)催化还原N2O4(g)的热化学方程式: .
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应为 . 
③常温下0.1molL﹣1的HCOONa溶液pH为10,则HCOOH的电离常数Ka=molL﹣1(填写最终计算结果).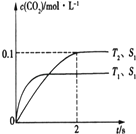
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸乙酯(化合物Ⅳ)是制备塑料、树脂等高聚物的重要中间体,可由下面路线合成: 
(1)化合物Ⅰ中含有的官能团有(填名称),1mol化合物Ⅳ完全燃烧消耗O2为mol.
(2)化合物Ⅱ能使溴的CCl4溶液褪色,其反应方程式为 .
(3)反应②属于反应,化合物Ⅰ可以由化合物Ⅴ(分子式为C3H6O)催化氧化得到,则化合物Ⅴ→Ⅰ的反应方程式为 .
(4)化合物Ⅵ是化合物Ⅳ的同分异构体,Ⅵ含有碳碳双键并能与NaHCO3溶液反应放出气体,其核磁共振氢谱峰面积之比为1:1:6,则化合物Ⅵ的结构简式为 .
(5)一定条件下,化合物 ![]() 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 .
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中含有共价键的离子化合物是( )
①MgF2 ②Na2O2 ③KOH ④CO2 ⑤NaClO ⑥H2SO4 ⑦NH3·H2O
A. ②③⑤B. ②③④⑤C. ①②③⑤D. ①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】倍半硅氧烷在液晶显示、塑料阻燃、生物医用等领域具有重要应用,氢基倍半硅氧烷的分子结构如图A所示,其加热分解产物中SiO2的晶胞结构如图B所示,回答下列问题: 
(1)基态Si原子的最外层电子排布式为 , 其中成对电子之间的主要区别是
(2)图A分子中H的化合价为 , Si原子采用杂化,形成的极性共价键类型为;键的极性Si﹣H键Si﹣O(填空“>”、“<”、“=”)
(3)图A分子结构中,一个硅原子被3个元环共有,硅的配位数为 , 该分子的分子式为
(4)氢基倍半硅氧烷为晶体,SiO2为晶体;
(5)每个SiO2晶胞含有Si原子的个数为;已知SiO2晶体为面心立体结构,晶胞参为anm,阿伏加德罗常数的值为NA , 则SiO2晶体的密度为gcm﹣3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《汉书》记载“高奴县有洧水,肥可燃”;《梦溪笔谈》描述“洧水”:“予疑其烟可用,试扫其煤以为墨,黑光如漆,松墨不及也……此物后必大行于世.”上述“洧水”和“煤”的主要成分分别是( )
A.石油和炭黑B.石油和焦炭
C.油脂和木炭D.油脂和石墨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com