
����Ŀ��Ŀǰ����̼���š����ܹ�ע��CO2�IJ�������Ч�������ó�Ϊ��ѧ���о�����Ҫ���⣮
��1������β����������Ҫԭ��Ϊ2NO��g��+2CO��g��2CO2��g��+N2��g�������ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������������S����ʱ�䣨I���ı仯������ͼ��ʾ���ݴ��жϣ�
�ٸ÷�Ӧ�ġ�H0���������������
����T2�¶��£�0��2s�ڵ�ƽ����Ӧ����v��N2��=mol/��Ls����
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����������ţ���
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⣮
��úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
���磺CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H=��867kJmol��1
2NO2��g���TN2O4��g����H=��56.9kJmol��1
д��CH4��g������ԭN2O4��g�����Ȼ�ѧ����ʽ�� ��
�ڽ�ȼú�����Ķ�����̼�������ã��ɴﵽ��̼�ŷŵ�Ŀ�ģ���ͼ��ͨ���˹�������ã���CO2��g����H2O��g��Ϊԭ���Ʊ�HCOOH��O2��ԭ��ʾ��ͼ������b���淢���ĵ缫��ӦΪ �� 
�۳�����0.1molL��1��HCOONa��ҺpHΪ10����HCOOH�ĵ��볣��Ka=molL��1����д���ռ���������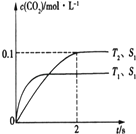
���𰸡�
��1������0.025��bd
��2��CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��g������H=��810.1kJ/mol��2CO2+4H++4e��=2HCOOH��10��7
����������1������ͼ1��֪���¶�T1�ȵ���ƽ�⣬���¶�T1��T2 �� �¶�Խ��ƽ��ʱ��������̼��Ũ��Խ�ͣ�˵�������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ������H��0���ʴ�Ϊ����������ͼ��֪��T2�¶�ʱ2s����ƽ�⣬ƽ��ʱ������̼��Ũ�ȱ仯��Ϊ0.2mol/L����v��CO2��= ![]() =0.05mol/��Ls��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��N2��=
=0.05mol/��Ls��������֮�ȵ��ڻ�ѧ������֮�ȣ���v��N2��= ![]() v��CO2��=
v��CO2��= ![]() ��0.05mol/��Ls��=0.025mol/��Ls�����ʴ�Ϊ��0.025mol/��Ls������a������ƽ���������������ȣ����ٱ仯��t1ʱ��V�����֮���淴Ӧ�������ʷ����仯��δ����ƽ�⣬��a����b���÷�Ӧ����ӦΪ���ȷ�Ӧ���淴Ӧ�����¶����ߣ���ѧƽ�ⳣ����С������ƽ����¶�Ϊ��ֵ������ߣ�ƽ�ⳣ�����䣬Ϊ��С��ͼ����ʵ�ʷ��ϣ���b��ȷ��c��t1ʱ�̺������̼��NO�����ʵ��������仯��t1ʱ��δ����ƽ��״̬����c����d��NO����������Ϊ��ֵ��t1ʱ�̴���ƽ��״̬����d��ȷ��
��0.05mol/��Ls��=0.025mol/��Ls�����ʴ�Ϊ��0.025mol/��Ls������a������ƽ���������������ȣ����ٱ仯��t1ʱ��V�����֮���淴Ӧ�������ʷ����仯��δ����ƽ�⣬��a����b���÷�Ӧ����ӦΪ���ȷ�Ӧ���淴Ӧ�����¶����ߣ���ѧƽ�ⳣ����С������ƽ����¶�Ϊ��ֵ������ߣ�ƽ�ⳣ�����䣬Ϊ��С��ͼ����ʵ�ʷ��ϣ���b��ȷ��c��t1ʱ�̺������̼��NO�����ʵ��������仯��t1ʱ��δ����ƽ��״̬����c����d��NO����������Ϊ��ֵ��t1ʱ�̴���ƽ��״̬����d��ȷ��
�ʴ�Ϊ��bd����2������֪����CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H1=��867kJ/mol
��2NO2��g��N2O4��g����H2=��56.9kJ/mol
���ݸ�˹���ɣ����CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��g�����ʡ�H=��867kJ/mol������56.9kJ/mol��=��810.1kJ/mol��
��CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��g������H=��810.1kJ/mol���ʴ�Ϊ��CH4��g��+N2O4��g��=N2��g��+CO2��g��+2H2O��g������H=��810.1kJ/mol������ͼ��֪������Ͷ��ˮ�����������������ӣ��缫a���淢��������Ӧ��Ϊ�������缫��ӦʽΪ2H2O��4e���TO2��+4H+ �� ����ͨ�������̼����������������HCOOH���缫b���淢����ԭ��Ӧ��Ϊ�������缫��ӦʽΪ2CO2+4e��+4H+�T2HCOOH���ʴ�Ϊ��2CO2+4H++4e��=2HCOOH���۳����£�0.1mol/L��HCOONa��ҺpHΪ10����Һ�д���HCOO��ˮ��HCOO��+H2OHCOOH+OH�� �� ��Kh= ![]() =10��7 �� ��HCOOH�ĵ��볣��Ka=
=10��7 �� ��HCOOH�ĵ��볣��Ka= ![]() =
= ![]() =10��7 �� �ʴ�Ϊ��10��7 ��
=10��7 �� �ʴ�Ϊ��10��7 ��
��1���ٸ��ݵ���ƽ���ʱ���ж��¶ȸߵͣ�����ƽ��ʱ������̼��Ũ���ж��¶ȶ�ƽ���Ӱ�죬�����жϡ�H������ͼ��֪��T2�¶�ƽ��ʱ��������̼��Ũ�ȱ仯��Ϊ0.1mol/L������v= ![]() ����v��CO2�����ٸ�������֮�ȵ��ڻ�ѧ������֮�ȼ���v��N2������A������ƽ���������������ȣ����ٱ仯��B������ƽ����¶�Ϊ��ֵ��ƽ�ⳣ�����䣬��Ϸ�Ӧ���ж��淴Ӧ�����������¶ȱ仯���ж��¶ȶԻ�ѧƽ�ⳣ����Ӱ�죻C��t1ʱ�̺������̼��NO�����ʵ��������仯������ٱ仯��D������ƽ������ֵĺ����������仯����2���ٸ��ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ�����ʵ���ϵ�����мӼ�����Ŀ���Ȼ�ѧ����ʽ������ͼ��֪������Ͷ��ˮ�����������������ӣ��缫a���淢��������Ӧ��Ϊ����������ͨ�������̼����������������HCOOH���缫b���淢����ԭ��Ӧ��Ϊ�������ۼ���ˮ��ƽ�ⳣ��Kh���ٸ���Ka=
����v��CO2�����ٸ�������֮�ȵ��ڻ�ѧ������֮�ȼ���v��N2������A������ƽ���������������ȣ����ٱ仯��B������ƽ����¶�Ϊ��ֵ��ƽ�ⳣ�����䣬��Ϸ�Ӧ���ж��淴Ӧ�����������¶ȱ仯���ж��¶ȶԻ�ѧƽ�ⳣ����Ӱ�죻C��t1ʱ�̺������̼��NO�����ʵ��������仯������ٱ仯��D������ƽ������ֵĺ����������仯����2���ٸ��ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ�����ʵ���ϵ�����мӼ�����Ŀ���Ȼ�ѧ����ʽ������ͼ��֪������Ͷ��ˮ�����������������ӣ��缫a���淢��������Ӧ��Ϊ����������ͨ�������̼����������������HCOOH���缫b���淢����ԭ��Ӧ��Ϊ�������ۼ���ˮ��ƽ�ⳣ��Kh���ٸ���Ka= ![]() ���㣮
���㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. ������ԭ��Ӧ�ı�����Ԫ�ػ��ϼ۷����仯
B. ��ԭ����һ���ܹ��õ����ӵ�����
C. ��������Ԫ�ػ��ϼ����ߵķ�Ӧ�ǻ�ԭ��Ӧ
D. ������Ӧ�ͻ�ԭ��Ӧ��ͬʱ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����м����жϾ���ȷ���ǣ� �� �� ![]() ��
�� ![]() ��Ϊͬλ�� ��
��Ϊͬλ�� �� ![]() ��
�� ![]() Ϊͬһ���ʢ�
Ϊͬһ���ʢ� ![]() ��
�� ![]() Ϊͬ���칹���O2��O3��Ϊͬ���������
Ϊͬ���칹���O2��O3��Ϊͬ��������� ![]() ��
�� ![]() Ϊͬϵ�� ��
Ϊͬϵ�� �� ![]() ��
�� ![]() Ϊ���㻯��� ��
Ϊ���㻯��� ��
A.�٢ۢܢ�
B.�٢ڢܢ�
C.�٢ڢݢ�
D.�ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û���Ӧ��ͨʽ������ͼ��ʾ�����ʼס��Һͻ�����A��BΪ��ѧ�������ʣ���ش��������⣺ 
��1����������A�����³�Һ̬��������B����ɫ��Ӧ�ʻ�ɫ����÷�Ӧ�����ӷ�Ӧ����ʽΪ
��2����ҵ�������û���Ӧԭ���Ʊ�һ�ְ뵼����ϣ�д���÷�Ӧ�Ļ�ѧ����ʽ
��3�������嵥�������ڿ�����ȼ�գ�������BΪ��ɫ���Ծ��壬д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������̼����ȼ�ϵ�ع���ԭ����ͼ��ʾ���������ƶϴ�����ǣ� ��
A.�ŵ�ʱ������CO2����
B.������ӦΪO2+2CO2+4e���T2CO32��
C.��ӦCH4+H2O ![]() 3H2+CO��ÿ����1molCH4ת��6mol ����
3H2+CO��ÿ����1molCH4ת��6mol ����
D.�õ�ؿ��ڳ��»����ʱ���й������Ի������н�ǿ����Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������������ȷ���ǣ�������
A.��״���£�2.24LH2O���еķ�����ĿΪ0.1NA
B.1mol/LCu��NO3��2��Һ��NO3������ĿΪ2NA
C.2.4gMgת���Mg2+ʧ���ӵ���ĿΪ0.2NA
D.6.2gNa2O����Na+����ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�ķ��ӿ�����죬��ѧ��ChrisScotton���÷����������ȡ��ΪPenguinone��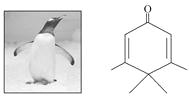
�����й�Penguinone��˵������ȷ����(����)
A.Penguinone�д������ֹ�����
B.Penguinone��һ�ַ���ȩ
C.Penguinone�д�������ϩ��ͬ�Ĺ����ţ�����������ϩ�����Ƶ�����
D.����÷����е�˫�����ܼӳɣ���1molPenguinone����3mol������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ����ﰱ�������ҩƷ��(����)
A. NH4Cl��Һ��NaOH��Һ����ʯ��
B. ���Ͱ�ˮ
C. NaOH��Һ��NH4Cl��Һ��Ũ����
D. NH4Cl���塢��ʯ�ҡ���ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1mol��ͪ��(  )�����Ĵ�����1mol���������ӳɷ�Ӧת������ᣬ������Ľṹ��ʽΪ��
)�����Ĵ�����1mol���������ӳɷ�Ӧת������ᣬ������Ľṹ��ʽΪ��
�������������£������������ͬ�����ŵ������ͬ���칹��A������ȥ��Ӧ����B������A����B�Ļ�ѧ����ʽΪ��
��B��״����ɵ������Ծۺϣ���þۺ���Ľṹ��ʽΪ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com