
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少
A.通入二氧化碳气体 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
科目:高中化学 来源: 题型:
下列说法错误的是
A. 由单质A转化为单质B,ΔH=+119kJ/mol,可知单质A比单质B稳定
B.灼热的碳与CO2反应既是氧化还原反应,又是生成物总能量高于反应物总能量的反应
C. 决定化学反应速率的根本因素是参加反应的各物质的结构和性质
D.对于一个可逆反应(ΔH<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞
的次数,使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用语的表示方法中错误的是
A.次氯酸的电子式: B.S2-的结构示意图:
B.S2-的结构示意图:
C.O—18的原子符号: D.CO2分子的结构式:O=C=O
D.CO2分子的结构式:O=C=O
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;② 、
、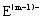 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1) HmDm的电子式___________________。
(2)  、
、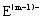 的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为_________________________________________________________。
的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为_________________________________________________________。
(3) 将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:
_________________________________________________________________。
(4) 常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式 。在该溶液中溶质中含有的化学键类型是
(5) 在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
CO(g)+H2O(g)  H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下
A.加入催化剂,加快了反应速率,反应的ΔH也随之改变
B.温度降低,正、逆反应速率都减小,反应放出的热量不变
C.恒容时充入稀有气体或充入H2,正、逆反应速率都减小
D.改变压强,反应速率发生改变,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
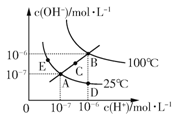
水的电离平衡曲线如图所示,下列说法正确的是
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NaOH固体的方法
D.若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.将H2S通入FeCl3溶液中会产生淡黄色沉淀,继续通入则会产生黑色沉淀
B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的最高温度作为末温度
C.分离Na2CO3溶液和CH3COOC2H5常用蒸馏法
D.能使湿润的KI淀粉试纸变蓝的气体一定是Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
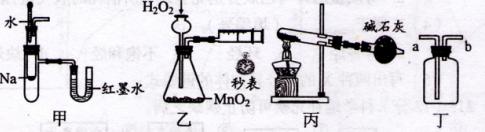
A.装置甲可用于验证反应的热效应
B.装置乙可定量测定化学反应的速率
C.装置丙可用于实验室以NH4Cl为原料制备少量NH3
D.装置丁a口进气可收集NH3、C12等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
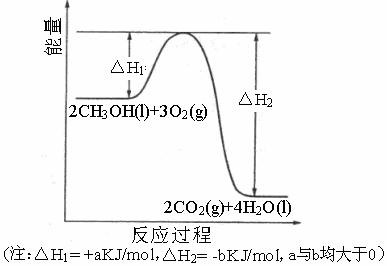
反应2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l)过程中的能量变化如下图所示。
2CO2(g)+4H2O(l)过程中的能量变化如下图所示。
回答下列问题:
(1)该反应是 反应(填“吸热”“放热)
(2)反应体系中加入催化剂对反应热是否有影响? (填“有”、“没有”)
(3)该反应的逆反应的活化能为
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的原电池装置:
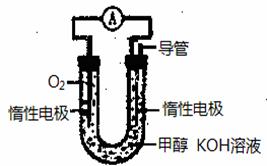
该电池负极电极反应式为
(5)甲醇燃烧产物 CO2在自然界循环时也可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。将0.6mol/L的CaCl2溶液与2.0mol/L的Na2CO3溶液等体积混合,则混合后钙离子的浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com