
【题目】已知草酸晶体(H2C2O4·2H2O)的熔点为 101℃,170℃分解。下列选用的装置和药品能达到实验目的的是( )
A | B | C | D |
|
|
|
|
制取SO2 | 制取NO2 | H2C2O4·2H2O分解 | 分离苯与溴苯 |
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):
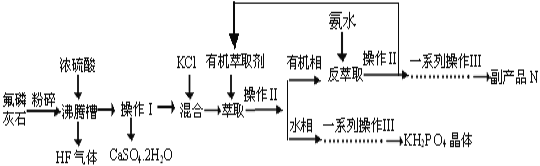
已知萃取的主要反应原理:KCl+H3PO4![]() KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl;其中,反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)流程中将氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材质的沸腾槽的主要原因是___________________(用化学方程式表示)。
(3)副产品N的化学式是____________;在得到KH2PO4晶体的一系列操作Ⅲ,其主要包括______________________________、过滤、洗涤、干燥等。
(4)若用1000kg质量分数为50.4%的氟磷灰石(化学式为Ca5P3FO12)来制取磷酸二氢钾晶体,其产率为80%,则理论上可生产KH2PO4的质量为_______kg。
(5)电解法制备KH2PO4的装置如图所示.该电解装置中,a 区属于_______区(填“阳极”或“阴极”),阴极区的电极反应式是______________________________________。

(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是( )
A.Na+、Fe3+、SO42-、SCN-B.H+、Fe2+、SO42-、NO3-
C.Ca2+、Al3+、NO3-、Cl-D.K+、NH4+、CO32-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在75℃左右,用HgS04做催化剂,乙炔可水化为乙醛,但HgS04遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、Hg0粉末五种物质制乙醛,装置如下图所示,请回答下列问题:

(1)实验开始时,仪器A中盛放电石,B中应装__________,其作用是__________。
(2)仪器D中盛放水,其作用是__________。
(3)蒸馏烧瓶F中应加入Hg0和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括Hg0在内的各试剂的名称____________________。
(4)装置图中,加热F的方法叫__________,所选用温度计G的量程表示正确的是________(填字母)。
A.0℃~50℃ B.0℃~100℃ C.0℃~200℃ D.50℃~100℃ E.0℃~360℃
(5)检验乙醛已制出的操作及现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色溶液中,离子可以大量共存的一组是
A. H+ Na+ OH- B. Na+ NO3- Cl-
C. K+ H+ HCO3- D. Cu2+ SO42- NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 18g2H2O中含有的中子数为10NA
B. 11.2 LCl2与足量NaOH 溶液反应时转移的电子数为0.5 NA
C. 1mol·L-1的Fe2(SO4)3溶液中含有的SO42-数为3 NA
D. 7 g 乙烯和丁烯的混合气体中所含的碳原子数是0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)_______c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________mol·L-1(填数值)。
(二)金属氢氧化物在酸中的溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下饱和溶液的浓度(mol·L1)如图所示。
(1)pH=3时溶液中铜元素的主要存在形式是________(填化学式)。

(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为______。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,_____ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是_______________________。
(4)要使氢氧化铜沉淀溶解,除加入酸外,还可以加入氨水,生成[Cu(NH3)4]2+,写出发生反应的离子方程式______________________。
(5)已知一些难溶物的溶度积常数如下表。
物质 | FeS | MnS | CuS |
Ksp | 6.3×1018 | 2.5×1013 | 1.3×1036 |
物质[] | PbS | HgS | ZnS |
Ksp | 3.4×1028 | 6.4×1053 | 1.6×1024 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的________(填字母)除去它们。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在-100 ℃的低温下合成了一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法不正确的是

A. X不能使酸性KMnO4溶液褪色
B. X的性质与烯烃类似,容易发生加成反应
C. X在常温下不能稳定存在
D. 充分燃烧等质量的X和甲烷,X消耗氧气比甲烷少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X,由Na+、Ag+、Ba2+、Al3+、Fe3+、AlO2—、CO32—、SO42—中的若干种离子组成,取该溶液进行如下实验:

(1)气体B的成分是______________。
(2)写出步骤②形成白色沉淀甲的离子方程式__________________________。
(3)通过上述实验,可确定X溶液中一定存在的离子是_________________________,尚未确定是否存在的离子是__________________,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com