
����Ŀ�������仯�����ڹ�ũҵ������������������ҪӦ�ã����ٵ����������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ��
��1����֪��N2(g)+O2(g)=2NO(g) ��H=+180.5kJ��mol��l
C(s)+O2(g)=CO2(g) ��H=�D393.5 kJ��mol��l
2C(s)+O 2(g)=2CO(g) ��H=�D221kJ��mol��l ��ij��Ӧ��ƽ�ⳣ������ʽΪ��![]() ����д���˷�Ӧ���Ȼ�ѧ����ʽ ______________________________��
����д���˷�Ӧ���Ȼ�ѧ����ʽ ______________________________��
��2��N2O5��һ�������¿ɷ����ֽ���2N2O5(g) ![]() 4NO2(g)��O2(g)��ij�¶��²�ú����ܱ�������N2O5Ũ����ʱ��ı仯���±���
4NO2(g)��O2(g)��ij�¶��²�ú����ܱ�������N2O5Ũ����ʱ��ı仯���±���

�� ��Ӧ��ʼʱ��ϵѹǿΪP0����3.00 minʱ��ϵѹǿΪp1����p1��p0�� _____________��2.00min~5.00 min�ڣ�O2��ƽ����Ӧ����Ϊ _______________��
��һ���¶��£��ں����ܱ������г���һ����N2O5���и÷�Ӧ�����жϷ�Ӧ�Ѵﵽ��ѧƽ��״̬���� ______________��
a.������ѹǿ���ٱ仯 b.NO2��O2������ȱ��ֲ���
c.2v��(NO2)��v��(N2O5) d.�����ƽ����Է�������Ϊ43.2���ұ��ֲ���
��3��N2O4��NO2 ֮����ڷ�Ӧ��N2O4(g) ![]() 2NO2(g) ��H=QkJ��mol��1����һ������N2O4��������ܱ������У������ƽ��ת���ʣ���(N2O4)�����¶ȱ仯��ͼ��ʾ��
2NO2(g) ��H=QkJ��mol��1����һ������N2O4��������ܱ������У������ƽ��ת���ʣ���(N2O4)�����¶ȱ仯��ͼ��ʾ��
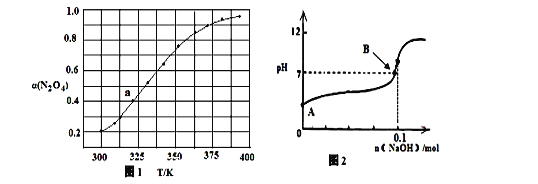
��ͼ��a���Ӧ�¶��£���֪N2O4����ʼѹǿp0Ϊ200 kPa�����¶��·�Ӧ��ƽ�ⳣ��Kp=________��С�������һλ���֣���ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
��4����������������Ͷ��0.1mol/L��HN3��������ᣩ��Һ���У���Һ�����1L����Һ����仯���Բ��ƣ���Һ��pH�仯��ͼ��ʾ��HN3�ĵ���ƽ�ⳣ��K=1��10��5��B��ʱ��Һ��pH=7������B��ʱ�����������Ƶ����ʵ��� ________mol��������λ��Ч���֣���
���𰸡� 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=�D746.5 kJ��mol��1 1.975 0.055 mol��L��1��min��1 a 213.3kPa 0.099
N2(g)+2CO2(g) ��H=�D746.5 kJ��mol��1 1.975 0.055 mol��L��1��min��1 a 213.3kPa 0.099
��������(1)���ݸ÷�Ӧ��ƽ�ⳣ������ʽΪ��![]() ����֪���÷�Ӧ�ķ���ʽΪ��2NO(g)+2CO(g)�TN2(g)+2CO2(g)����N2(g)+O2(g)�T2NO(g)��H=+180.5kJmol-1����C(s)+O2(g)�TCO2(g)��H=-393.5kJmol-1����2C(s)+O2(g)�T2CO(g)��H=-221.0kJmol-1�����ݸ�˹���ɼ������2-��-�۵õ��Ȼ�ѧ����ʽ 2NO(g)+2CO(g)�TN2(g)+2CO2(g)��H=-746.5kJmol-1 ���ʴ�Ϊ��2NO(g)+2CO(g)�TN2(g)+2CO2(g)��H=-746.5kJmol-1��
����֪���÷�Ӧ�ķ���ʽΪ��2NO(g)+2CO(g)�TN2(g)+2CO2(g)����N2(g)+O2(g)�T2NO(g)��H=+180.5kJmol-1����C(s)+O2(g)�TCO2(g)��H=-393.5kJmol-1����2C(s)+O2(g)�T2CO(g)��H=-221.0kJmol-1�����ݸ�˹���ɼ������2-��-�۵õ��Ȼ�ѧ����ʽ 2NO(g)+2CO(g)�TN2(g)+2CO2(g)��H=-746.5kJmol-1 ���ʴ�Ϊ��2NO(g)+2CO(g)�TN2(g)+2CO2(g)��H=-746.5kJmol-1��
(2) ����ͬ�����£���������ʵ���֮�ȵ�����ѹǿ֮�ȣ�
2N2O5(g)�T4NO2(g)+O2(g)
��ʼ(mol/L)1.00 0 0
��Ӧ(mol/L)0.65 1.30 0.325
3min(mol/L)0.35 1.30 0.325
��Ӧǰ�������ѹǿ֮�ȵ��������ʵ���֮�ȣ�����p1��p0=(0.35+1.30+0.325)mol��1.00mol=1.975��v(N2O5)= ![]() mol/(L��min)=0.11mol/(L��min)���ٸ���ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȵ�������Ӧ����Ϊ0.055molL-1min-1���ʴ�Ϊ��1.975��0.055molL-1min-1��
mol/(L��min)=0.11mol/(L��min)���ٸ���ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȵ�������Ӧ����Ϊ0.055molL-1min-1���ʴ�Ϊ��1.975��0.055molL-1min-1��
��a��������ѹǿ���ٱ仯����Ӧ�Ѵﵽ��ѧƽ��״̬����a��ȷ��b��NO2��O2�������ʼ�ն����䣬����ȷ����Ӧ�Ƿ�ﵽ��ѧƽ��״̬����b����c������(NO2)=2����(N2O5)�ű����ﵽ��ѧƽ��״̬����c����d��ƽ��ʱ�������ƽ����Է�������Ϊ����43.2���ұ��ֲ��䣮��d����ѡa��
(3)������������ת������0.4����ԭ�����������������ʵ���Ϊxmol��ת�������ʵ���Ϊ0.4xmol�����ɵĶ������������ʵ���Ϊ0.8xmol��������������ʵ���=(x-0.4x+0.8x)mol=1.4xmol����ͬ�����£������ѹǿ֮�ȵ��������ʵ���֮�ȣ����Է�Ӧ��ѹǿ=![]() ��1.4xmol=280kPa�������������ķ�ѹ=280kPa��
��1.4xmol=280kPa�������������ķ�ѹ=280kPa��![]() =120kPa�����������ķ�ѹ=280kPa��
=120kPa�����������ķ�ѹ=280kPa��![]() =160kPa����ѧƽ�ⳣ��K=
=160kPa����ѧƽ�ⳣ��K=![]() =
=![]() =213.3 kPa���ʴ�Ϊ��213.3��
=213.3 kPa���ʴ�Ϊ��213.3��
(4)�ɵ���غ�ʽc(Na+)+c(H+)=c(OH-)+c(N3-)��B��ʱ��Һ��pH=7�ã�c(Na+)=c(N3-)�����������Ƶ����ʵ���Ϊxmol������HN3H++N3-�ĵ���ƽ�⣺K=1��10-5=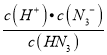 =
=![]() ����ã�x=0.099mol���ʴ�Ϊ��0.099��
����ã�x=0.099mol���ʴ�Ϊ��0.099��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ��ر���ԭ��ͭ�����ᆳ�������������ú��ɣã��ӣ�����Һ������²������������ܵģڣ�ӻ�У�ӣ�����ת��Ϊͭ�����ã��ӣ������з�����ȷ����
A. �ã��ӵ��ܽ�ȴ��ڣУ�ӵ��ܽ��
B. ԭ��ͭ��������л�ԭ�ԣ���ͭ��û�л�ԭ��
C. �ã��ӣ�����ڣ�ӷ�Ӧ�����ӷ���ʽ��![]()
![]() �����
�����
D. ���������漰�ķ�Ӧ������������ԭ��Ӧ���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ�û�����ܴﵽĿ�ĵ���


A. װ�������ڲⶨ��������������
B. װ����������ɫ�����Ƚ�Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
C. װ��������U������Һ��ĸߵ��ж�Na��ˮ��Ӧ����ЧӦ
D. װ�������ݳ��ֻ��ǵĿ����Ƚ��¶ȶԷ�Ӧ���ʵ�Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO4)��һ�ָ�Ч��ˮ����ͬʱҲ�Ǹ��ܵ���������������ϡ���֪��K2FeO4 ������ˮ������Һ����ɫ������ŨKOH��Һ����0��~5����ǿ������Һ�н��ȶ���ijС��ͬѧ��������װ���Ʊ���̽��������ص����ʡ�
I��K2FeO4���Ʊ���װ����ͼ��ʾ(�г�װ����)��
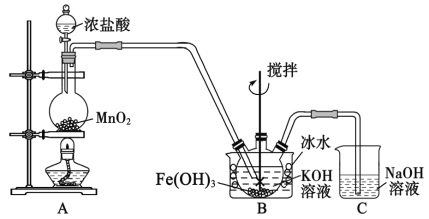

��1��ʢ�Ŷ������̵�����������_______________��
��2��װ��B�з�Ӧ�Ļ�ѧ����ʽ��_______________��
��3��ʵ��ʱ���ñ�ˮԡ��ԭ����___________________��������ʾ������ͼװ���еķ�Һ©����Ϊ��ͼ��ʾ�ĺ�ѹ��Һ©������Ŀ����_________________��
��4��K2FeO4�ֲ�Ʒ����Fe(OH)3��KCl�����ʣ�һ����75���Ҵ�����ϴ�ӣ���Ŀ����__________��
II��K2FeO4���ʵ�̽��
��������֪��K2FeO4�ܽ�Mn2+������![]() ��ijʵ��С���������ʵ�������֤��
��ijʵ��С���������ʵ�������֤��
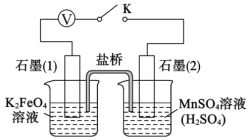
�ر�K���������ձ���Һ���ɫ�����ձ���Һ����ɫ����������ձ���Һ�ʻ�ɫ��ԭ����Ҫ���Լ���__________��д��ʯī(2)�Ϸ����ĵ缫��Ӧʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɻ�������Ƶ�1,2��������������Ӧ�������£�

����˵����������
A. �ٵķ�Ӧ�����ǹ��� B. �ڵķ�Ӧ��������ȥ��Ӧ
C. �۵ķ�Ӧ������ȡ����Ӧ D. �ܵķ�Ӧ������NaOH��H2O����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25��ʱ��Ksp[Zn(OH)2]=1.0��10-18��Ka(HCOOH)=1.0��10-4�����¶��£�����˵���������
A. Zn(OH)2����ˮ�γɵı�����Һ��c(Zn2+)>1.0��10-6 mol��L-l
B. HCOO-��ˮ�ⳣ��Ϊ1.0��10-10
C. ��Zn(OH)2����Һ�м���HCOOH,��Һ��c(Zn2+)����
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O��ƽ�ⳣ��K=100
=Zn2++2HCOO-+2H2O��ƽ�ⳣ��K=100
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷ���Al2O33H2O��������SiO2��Fe2O3�����ʡ���ҵ�ϴ�����������ȡAl�ɲ�����ͼ��ʾ�������̡������ֲ������Ƽ���Ӧ��������ȥ��

(1)A���������___��
(2)д���������ʵĻ�ѧʽ��B___��X___��F___��
(3)��M�������Ļ�ѧ����ʽ��_______�����б���ʯ��������___������1mol������ʱ��ת�Ƶ���___mol��
(4)����C���ȷֽ�Ļ�ѧ����ʽ��___��
(5)��������C�ֽ����ɵĽ��������ﷴӦ���仯ѧ����ʽ��___���÷�Ӧ������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���ʾΪԪ�����ڱ��Ķ����ڣ����г������Ԫ���⣬���е�ÿ����ű�ʾ��Ԫ�ء�
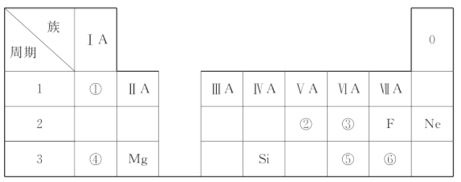
(1)�ܱ�ʾ��Ԫ����________(��Ԫ�ط���)��
(2)�ڡ�������Ԫ����Ƚϣ�ԭ�Ӱ뾶�ϴ����________(��Ԫ�ط���)��
(3)���������Ԫ�����γɻ�����ĵ���ʽ��________��
(4)Ԫ�صķǽ�����ǿ���Ƚϣ���________��(����>������<��)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com