
【题目】下列装置或操作能达到目的的是


A. 装置①用于测定生成氢气的速率
B. 装置②依据褪色快慢比较浓度对反应速率的影响
C. 装置③依据U管两边液面的高低判断Na和水反应的热效应
D. 装置④依据出现浑浊的快慢比较温度对反应速率的影响
【答案】C
【解析】
装置①生成的氢气可以由长颈漏斗溢出;装置②两种高锰酸钾溶液的浓度不同、颜色不同,不符合控制变量法;Na和水反应放热,广口瓶内气体受热膨胀,U型管左侧液面下降,右侧液面上升;装置④中浓度、温度都不同,无法判断温度对速率的影响;
装置①生成的氢气可以由长颈漏斗逸出,不能根据生成氢气的体积测定生成氢气的速率,故A错误;装置②依据褪色快慢比较浓度对反应速率的影响,应保证高锰酸钾溶液的浓度相同,用不同浓度的草酸(乙二酸)来做实验,故B错误;Na和水反应放热,广口瓶内气体受热膨胀,U型管左侧液面下降,右侧液面上升,所以装置③能实现目的,故C正确;装置④中浓度、温度都不同,无法判断温度对速率的影响,故D错误。


科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )

A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
D.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,铁片、铜片和硫酸铜溶液可以构成原电池或电解池,下列说法不正确的是( )

A.构成原电池时,Cu极反应为![]()
B.构成电解池时,Fe电极质量一定减少
C.构成电解池时,Cu极质量可能增加也可能减少
D.构成的原电池或电解池在工作时的反应原理可能相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是
A.pH =4.3的CH3COOH与CH3COONa混合溶液中:c(Na+) < c(CH3COO-)
B.浓度为0.2 mol/L的CH3COOH溶液和浓度为0.1 mol/L的NaOH溶液等体积混合后:c(CH3COO-) - c(CH3COOH) = 2[c(H+) - c(OH-)]
C.醋酸浓溶液加少量水稀释,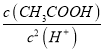 几乎不变
几乎不变
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+) = 2[c(HC2O4-) + c(C2O42-) + c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络图片“一脸辛酸”中,出现了有机物辛酸(分子式:C8H16O2,键线式:![]() )。辛酸天然品存在于肉豆蔻、柠檬草、苹果、椰子油、葡萄酒、酒花等中,稀释后呈现水果香气。下列说法中正确的是
)。辛酸天然品存在于肉豆蔻、柠檬草、苹果、椰子油、葡萄酒、酒花等中,稀释后呈现水果香气。下列说法中正确的是

A.只要含碳的化合物就是有机物
B.辛酸属于烷烃
C.有机物只溶于有机溶剂,不溶于水,所以辛酸不溶于水
D.许多有机物不仅存在于生物体内,也可以人工合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年春节前后,世界各地爆发了新型冠状病毒疫情。在疫情面前,我国人民众志成城,奋力战疫。
(1)疫情期间,更应合理饮食。山西人喜欢以“面”为主食,“面”中富含的营养物质是___,面在人体中各种酶的作用下发生水解,最终生成___(填化学式),与其互为同分异构体的一种物质的名称是___。
(2)加强锻炼,增强体质,是抗疫的最佳途径。通过锻炼可以消耗身体内多余脂肪,脂肪在人体中所起的主要作用是___。
(3)医用口罩中对阻挡病毒起关键作用的是熔喷布(主要原料是聚丙烯),由丙烯(CH3CH=CH2)在一定条件下制取聚丙烯的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读下图,下列判断不正确的是
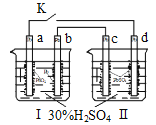
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol
C.K闭合时,II中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·molˉl
C(s)+O2(g)=CO2(g) △H=―393.5 kJ·molˉl
2C(s)+O 2(g)=2CO(g) △H=―221kJ·molˉl 若某反应的平衡常数表达式为:![]() ,请写出此反应的热化学方程式 ______________________________。
,请写出此反应的热化学方程式 ______________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g) ![]() 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:

① 反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0= _____________;2.00min~5.00 min内,O2的平均反应速率为 _______________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是 ______________。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g) ![]() 2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
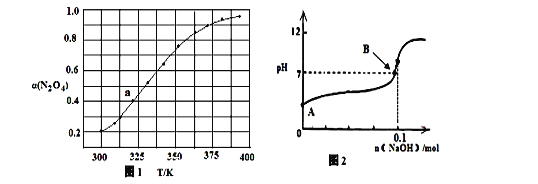
如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=________(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量 ________mol(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com