
【题目】高铁酸钾(K2FeO4)是一种高效净水剂,同时也是高能电池正极的优良材料。已知:K2FeO4 易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学拟用以下装置制备并探究高铁酸钾的性质。
I.K2FeO4的制备,装置如图所示(夹持装置略):
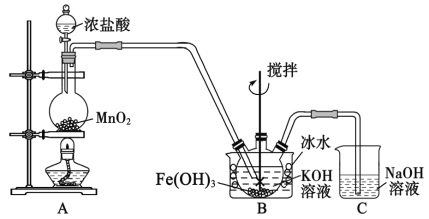

(1)盛放二氧化锰的仪器名称是_______________。
(2)装置B中反应的化学方程式是_______________。
(3)实验时采用冰水浴的原因是___________________,有人提示,将上图装置中的分液漏斗改为如图所示的恒压分液漏斗,其目的是_________________。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是__________。
II.K2FeO4性质的探究
查阅资料知,K2FeO4能将Mn2+氧化成![]() ,某实验小组设计如下实验进行验证:
,某实验小组设计如下实验进行验证:
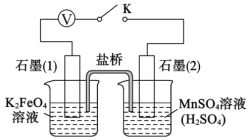
关闭K,发现左烧杯溶液变黄色,右烧杯溶液变紫色。检验左侧烧杯溶液呈黄色的原因,需要的试剂是__________。写出石墨(2)上发生的电极反应式:_____________。
【答案】圆底烧瓶(或烧瓶) 3Cl2 + 2Fe(OH)3 + 10KOH = 2K2FeO4 + 6KCl + 8H2O K2FeO4在0℃~5℃环境中稳定,防止副反应发生 平衡压强,确保浓盐酸匀速滴下 减少产品损失,易于干燥 硫氰酸钾溶液(KSCN溶液) Mn2+ -5e- + 4H2O = MnO4- + 8H+
【解析】
I.根据实验装置图可知,A装置中用二氧化锰与浓盐酸加热制得氯气,B中氯气、氢氧化钾和氢氧化铁反应生成K2FeO4,氯气有毒不能直接排空,氯气能和NaOH溶液反应生成钠盐,所以用NaOH溶液除去尾气,据此分析解答;
II.关闭K,左烧杯溶液变黄色,右烧杯溶液变紫色,说明该装置构成原电池,左侧得电子生成铁离子,为正极,右侧失电子生成高锰酸根离子,为负极,据此分析解答。
(1)根据图示,盛放二氧化锰的仪器为圆底烧瓶,故答案为:圆底烧瓶;
(2)装置B中,氯气、氢氧化钾和氢氧化铁反应生成K2FeO4,反应的化学方程式是3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,故答案为:3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O;
(3)根据题意信息,K2FeO4在0℃~5℃的强碱性溶液中较稳定,所以采用冰水浴,从而防止副反应发生;装置A中有气体生成,随着反应的进行,A中的压强增大,不利于浓盐酸的下滴,将装置中的分液漏斗改为恒压分液漏斗,可以平衡压强,确保浓盐酸匀速滴下,故答案为:K2FeO4在0℃~5℃的强碱性溶液中较稳定,防止副反应发生;平衡压强,确保浓盐酸匀速滴下;
(4)K2FeO4在乙醇中溶解度较小,且乙醇易挥发,所以用乙醇洗涤,可以减少产品损失,且易于干燥,故答案为:减少产品损失,易于干燥;
(5)关闭K,左烧杯溶液变黄色,右烧杯溶液变紫色,说明该装置构成原电池,左侧得电子生成铁离子,右侧失电子生成高锰酸根离子;铁离子和KSCN溶液反应生成络合物而使溶液呈血红色,所以需要KSCN溶液检验铁离子;FeO42-、Mn2+发生氧化还原反应生成铁离子、高锰酸根离子和水,反应方程式为5FeO42-+3Mn2++16H+=5Fe3++3MnO4-+8H2O,FeO42-得到电子发生还原反应,左侧为正极,则石墨(2)为负极,Mn2+失去电子发生氧化反应,电极反应式为Mn2+ -5e- + 4H2O = MnO4- + 8H+,故答案为:KSCN溶液;Mn2+ -5e- + 4H2O = MnO4- + 8H+。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络图片“一脸辛酸”中,出现了有机物辛酸(分子式:C8H16O2,键线式:![]() )。辛酸天然品存在于肉豆蔻、柠檬草、苹果、椰子油、葡萄酒、酒花等中,稀释后呈现水果香气。下列说法中正确的是
)。辛酸天然品存在于肉豆蔻、柠檬草、苹果、椰子油、葡萄酒、酒花等中,稀释后呈现水果香气。下列说法中正确的是

A.只要含碳的化合物就是有机物
B.辛酸属于烷烃
C.有机物只溶于有机溶剂,不溶于水,所以辛酸不溶于水
D.许多有机物不仅存在于生物体内,也可以人工合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读下图,下列判断不正确的是
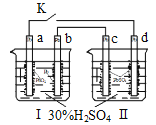
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol
C.K闭合时,II中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:
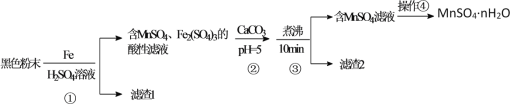
下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·molˉl
C(s)+O2(g)=CO2(g) △H=―393.5 kJ·molˉl
2C(s)+O 2(g)=2CO(g) △H=―221kJ·molˉl 若某反应的平衡常数表达式为:![]() ,请写出此反应的热化学方程式 ______________________________。
,请写出此反应的热化学方程式 ______________________________。
(2)N2O5在一定条件下可发生分解:2N2O5(g) ![]() 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:

① 反应开始时体系压强为P0,第3.00 min时体系压强为p1,则p1:p0= _____________;2.00min~5.00 min内,O2的平均反应速率为 _______________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是 ______________。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2,且保持不变
(3)N2O4与NO2 之间存在反应:N2O4(g) ![]() 2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g) △H=QkJ·molˉ1。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
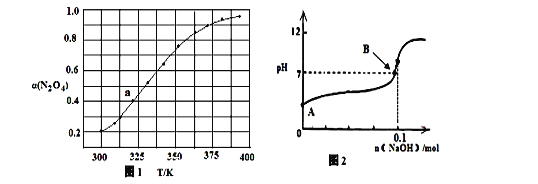
如图中a点对应温度下,已知N2O4的起始压强p0为200 kPa,该温度下反应的平衡常数Kp=________(小数点后保留一位数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)将固体氢氧化钠投入0.1mol/L的HN3(氢叠氮酸)溶液当中,溶液的体积1L(溶液体积变化忽略不计)溶液的pH变化如图所示,HN3的电离平衡常数K=1×10-5,B点时溶液的pH=7,计算B点时加入氢氧化钠的物质的量 ________mol(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH>4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000mol/LNaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和
D.室温下,将CH3COONa溶液加水稀释,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,其蒸气相对于氢气的密度为58,它能与小苏打反应放出CO2,也能使溴水褪色,0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应。试回答:
(1)该有机物中各原子个数比N(C)∶N(H)∶N(O)= ______________
(2)该有机物的摩尔质量为__________,写出分子式_____________
(3)该有机物的可能结构简式有___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在指定的环境下可以大量共存的是( )
A.在pH=0的溶液中:Na+、Fe2+、Cl-、![]()
B.由水电离出的c(H+)=1×10-14mol/L的溶液:K+、![]() 、Cl-、
、Cl-、![]()
C.c(H+)<c(OH-)溶液:Na+、K+、![]() 、
、![]()
D.PH=2的一元酸和PH=12的一元强碱等体积混合:c(OH-)=C(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com