
【题目】含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,其蒸气相对于氢气的密度为58,它能与小苏打反应放出CO2,也能使溴水褪色,0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应。试回答:
(1)该有机物中各原子个数比N(C)∶N(H)∶N(O)= ______________
(2)该有机物的摩尔质量为__________,写出分子式_____________
(3)该有机物的可能结构简式有___________________
【答案】1:1:1 116g/mol C4H4O4 HOOC-CH=CH-COOH 、CH2=C(COOH)2
【解析】
(1)含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,则该有机物中各原子个数比N(C)∶N(H)∶N(O)=![]() ;
;
(2)有机物的最简式为CHO,该有机物的摩尔质量为58×2g/mol,设分子式(CHO)n,则29n=58×2,n=4,分子式为C4H4O4;
(3)它能与小苏打反应放出CO2,说明分子中含有-COOH;也能使溴水褪色,说明分子内含有碳碳不饱和键;0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应,则1mol该有机物含有2mol-COOH;与同数碳原子的烷烃相比,分子中除含2个羧基外,还应含有一个碳碳双键。由此可确定该有机物的可能结构简式。
(1)含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,则该有机物中各原子个数比N(C)∶N(H)∶N(O)=![]() =1:1:1;答案为:1:1:1;
=1:1:1;答案为:1:1:1;
(2)有机物的最简式为CHO,该有机物的摩尔质量为58×2g/mol,设分子式为(CHO)n,则29n=58×2,n=4,分子式为C4H4O4;答案为:116g/mol;C4H4O4;
(3)它能与小苏打反应放出CO2,说明分子中含有-COOH;也能使溴水褪色,说明分子内含有碳碳不饱和键;0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应,则1mol该有机物含有2mol-COOH;与同数碳原子的烷烃相比,分子中除含2个羧基外,还应含有一个碳碳双键,由此可确定该有机物的可能结构简式中,两个羧基可能连在两个不同的双键碳原子上,也可能连在同一个双键碳原子上。答案为:HOOC-CH=CH-COOH 、CH2=C(COOH)2。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容密闭容器中发生可逆反应![]() ,X、Y、Z的初始浓度分别为2.0 mol·L-1和1.0 mol·L-1,2.0 mol·L-1,达平衡后,下列数据肯定不正确的是( )
,X、Y、Z的初始浓度分别为2.0 mol·L-1和1.0 mol·L-1,2.0 mol·L-1,达平衡后,下列数据肯定不正确的是( )
A.c(X)=0.5 mol·L-1B.c(Y)=0.5 mol·L-1
C.c(Z)=0.5 mol·L-1D.c(Z)=3.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂,同时也是高能电池正极的优良材料。已知:K2FeO4 易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学拟用以下装置制备并探究高铁酸钾的性质。
I.K2FeO4的制备,装置如图所示(夹持装置略):
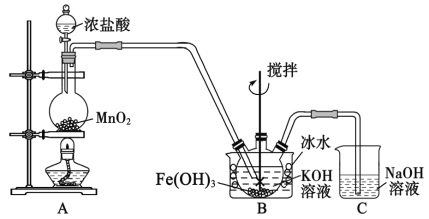

(1)盛放二氧化锰的仪器名称是_______________。
(2)装置B中反应的化学方程式是_______________。
(3)实验时采用冰水浴的原因是___________________,有人提示,将上图装置中的分液漏斗改为如图所示的恒压分液漏斗,其目的是_________________。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是__________。
II.K2FeO4性质的探究
查阅资料知,K2FeO4能将Mn2+氧化成![]() ,某实验小组设计如下实验进行验证:
,某实验小组设计如下实验进行验证:
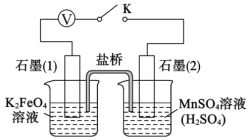
关闭K,发现左烧杯溶液变黄色,右烧杯溶液变紫色。检验左侧烧杯溶液呈黄色的原因,需要的试剂是__________。写出石墨(2)上发生的电极反应式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6 mol·L-l
B. HCOO-的水解常数为1.0×10-10
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O的平衡常数K=100
=Zn2++2HCOO-+2H2O的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是巨大的化学资源宝库,人类每年都会从海水中提取很多物质,如图是海水资源综合利用的部分流程。
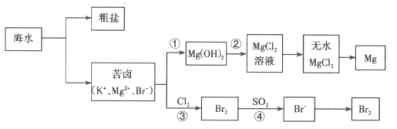
请回答下列问题:
(1)从海水中获取粗盐的方法是___。
(2)步骤①中所加试剂是___,步骤②中发生反应的离子方程式是___。
(3)步骤③中发生反应的离子方程式是___。
(4)步骤④中用“热空气”能从溶液中将Br2吹出的原因是___,用SO2水溶液吸收吹出的Br2时,反应过程中的氧化剂是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O33H2O,还含有SiO2、Fe2O3等杂质。工业上从铝土矿中提取Al可采用如图所示工艺流程。(部分操作名称及反应条件已略去)

(1)A中的阳离子是___。
(2)写出下列物质的化学式:B___,X___,F___。
(3)由M生成铝的化学方程式是_______,其中冰晶石的作用是___,当有1mol铝生成时,转移电子___mol。
(4)沉淀C受热分解的化学方程式是___。
(5)铝可以与C分解生成的金属氧化物反应,其化学方程式是___,该反应可用于___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是
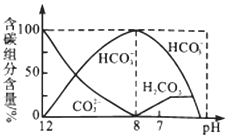
A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2: 1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积![]() 的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液
的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液![]() 与pH的变化关系如图所示,则( )
与pH的变化关系如图所示,则( )
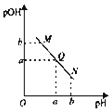
A.M点所示溶液的导电能力强于Q
B.M点的溶液显碱性,N点溶液显酸性
C.M点和N点所示溶液中水的电离程度相同
D.Q点溶液的pH一定为7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com