
【题目】某温度下,向一定体积![]() 的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液
的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液![]() 与pH的变化关系如图所示,则( )
与pH的变化关系如图所示,则( )
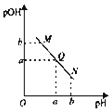
A.M点所示溶液的导电能力强于Q
B.M点的溶液显碱性,N点溶液显酸性
C.M点和N点所示溶液中水的电离程度相同
D.Q点溶液的pH一定为7
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,其蒸气相对于氢气的密度为58,它能与小苏打反应放出CO2,也能使溴水褪色,0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应。试回答:
(1)该有机物中各原子个数比N(C)∶N(H)∶N(O)= ______________
(2)该有机物的摩尔质量为__________,写出分子式_____________
(3)该有机物的可能结构简式有___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在指定的环境下可以大量共存的是( )
A.在pH=0的溶液中:Na+、Fe2+、Cl-、![]()
B.由水电离出的c(H+)=1×10-14mol/L的溶液:K+、![]() 、Cl-、
、Cl-、![]()
C.c(H+)<c(OH-)溶液:Na+、K+、![]() 、
、![]()
D.PH=2的一元酸和PH=12的一元强碱等体积混合:c(OH-)=C(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42-从右向左移动。下列分析正确的是

A.溶液中A2+浓度减小
B.B 的电极反应: B-2eˉ=B2+
C.y 电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组利用压强传感器、数据采集器和计算机等数字化实验设备,探究用0.01g镁条分别与2mL不同浓度稀盐酸的反应速率。实验结果如图所示。
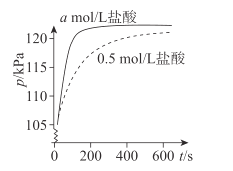
(1)Mg与盐酸反应的离子方程式是________。
(2)从微粒角度分析,该实验是为了探究________(因素)对该反应的化学反应速率的影响。
(3)a________0.5(填“>”或“<”)。
(4)如果用0.5mol/L硫酸代替上述实验中的0.5mol/L盐酸,二者的反应速率是否相同____,请说明原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是生活中常用的消毒剂,可与硫酸反应制取氯气,反应原理为NaClO+NaCl+H2SO4![]() Na2SO4+Cl2↑+H2O,为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
Na2SO4+Cl2↑+H2O,为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
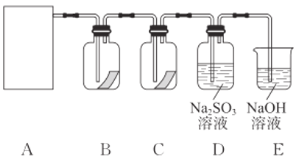
(1)上述制备氯气的反应中,每生成1molCl2,转移的电子的物质的量是________mol。
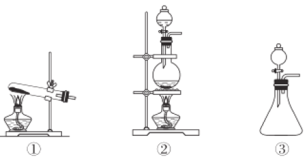
(2)依据上述反应原理,从下列装置中选择合适的制氯气装置(A处)________(填序号)。
(3)装置B、C中依次盛放的是干燥的红色布条和湿润的红色布条,其目的是________。实验过程中该同学发现装置B中的布条也褪色,说明该装置存在明显的缺陷,改进的方法是________。
(4)E中NaOH溶液吸收氯气时发生反应的化学方程式是________。
(5)D中氯气可将![]() 氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是________(写出操作、试剂和现象)。
氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是________(写出操作、试剂和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中不仅有物质变化而且伴随着能量变化。
(1)以下实验中属于吸热反应的是________(填序号)。

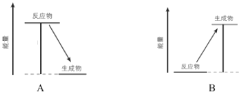
(2)下图中,表示放热反应能量变化的是_______(填字母)。
(3)从微观角度分析化学反应中能量变化的原因:
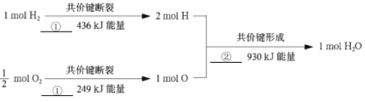
图中①和②分别为_______、_______(填“吸收”或“释放”)。氢气与氧气反应生成1mol水蒸气时,释放________kJ能量。
(4)当前,很多地区倡导用天然气替代煤作为家用燃料,根据下表从尽可能多的角度分析其原因是__。
燃料 | 燃烧释放的能量(每1千克) |
天然气 | 55812kJ |
煤 | 20908kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是___(多选扣分)。
a.υ正(H2)=υ逆(H2O) b.反应停止,正、逆反应速率都等于零
c.容器中压强不再发生变化 d.混合气体中c(CO2)不变
(4)某温度下,在2L的密闭容器中,加入1 molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为__℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,CO2的平衡转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L1 H2R溶液中H2R、HR、R2三者中所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列表述正确的是

A. Na2R溶液中:c(Na+)=c(HR)+2c(R2)
B. H2R![]() H++HR,Ka1=1.0×101.3
H++HR,Ka1=1.0×101.3
C. 等物质的量的NaHR和Na2R溶于水,使得溶液pH恰好为4.3
D. HF的Ka=1.0×103.4,在足量NaF溶液中加入少量H2R,发生反应:H2R+2F![]() 2HF+R2
2HF+R2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com