
【题目】某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42-从右向左移动。下列分析正确的是

A.溶液中A2+浓度减小
B.B 的电极反应: B-2eˉ=B2+
C.y 电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
【答案】D
【解析】
图B中的两电极均为石墨,即B装置为电解装置,A装置为原电池装置。当 K 闭合时,在交换膜处 SO42一从右向左移动,即可知A电极为原电池的负极,B为原电池的正极,所以y电极为电解池装置的阳极,x电极为电解池装置的阴极。
A、A处的电极反应式为:A-2e-=A2+;溶液中A2+增大,A错误;
B、B电极是正极得电子的一极,B错误;
C、在y中,电极反应式为:2Cl-—2e-=Cl2↑,C错误;
D、在x极,电极反应式为:2H++2e-=H2↑,破坏了附近的水的电离平衡,在x周围,c(OH-)增大,生成氢氧化铝沉淀,随c(OH-)溶液的增大,氢氧化铝逐渐溶解,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6 mol·L-l
B. HCOO-的水解常数为1.0×10-10
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O的平衡常数K=100
=Zn2++2HCOO-+2H2O的平衡常数K=100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是
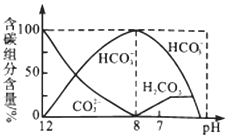
A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2: 1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所示为元素周期表的短周期,其中除标出的元素外,表中的每个编号表示种元素。
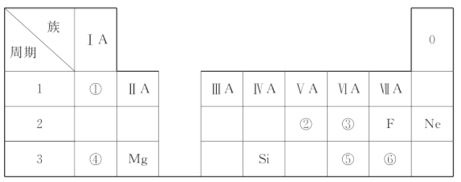
(1)④表示的元素是________(填元素符号)。
(2)②、③两种元素相比较,原子半径较大的是________(填元素符号)。
(3)①与⑥两种元素所形成化合物的电子式是________。
(4)元素的非金属性强弱比较:⑤________⑥(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素。5种元素的部分特点:
元素 | 特点 |
X | 其气态氢化物呈三角锥形,水溶液显碱性 |
Y | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
Z | 元素原子的外围电子层排布式为nsn-1npn-1 |
Q | 被誉为“太空金属”、“生物金属”,其基态原子最高能级有3个空轨道 |
W | 原子M能层为全充满状态且核外的未成对电子只有一个 |
(1)XF3分子中X的杂化类型为______,该分子的空间构型为_______。
(2)基态Q原子的电子排布式为_____________________,第一电离能:X______Y(填“>” “<”或“=”)。
(3)X、Y、Z电负性由大到小的顺序为____________(用元素符号表示)。
(4)Na在Y2中燃烧产物的电子式为________________。
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于_______晶体。
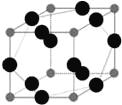
(6)W元素与X元素形成某种化合物的晶胞结构如图所示(黑球代表W原子),若该晶体的密度为ρ g·cm-3,则该晶胞的体积是__________cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.任何浓度的溶液都可以用pH来表示其酸碱性的强弱
B.某溶液中由水电离出的![]()
![]() ,若
,若![]() ,则该溶液的pH一定为
,则该溶液的pH一定为![]()
C.![]()
![]()
![]() 溶液中的
溶液中的![]() 是
是![]()
![]()
![]() 溶液中的
溶液中的![]() 的2倍
的2倍
D.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积![]() 的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液
的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液![]() 与pH的变化关系如图所示,则( )
与pH的变化关系如图所示,则( )
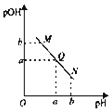
A.M点所示溶液的导电能力强于Q
B.M点的溶液显碱性,N点溶液显酸性
C.M点和N点所示溶液中水的电离程度相同
D.Q点溶液的pH一定为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时弱电解质的电离平衡常数: Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。将20 mL 0.10 mol·L-1CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图所示。反应开始时,两种溶液产生CO2的速率明显不同的原因是___________
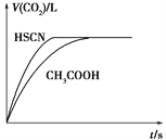
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com