
【题目】下列叙述正确的是( )
A.任何浓度的溶液都可以用pH来表示其酸碱性的强弱
B.某溶液中由水电离出的![]()
![]() ,若
,若![]() ,则该溶液的pH一定为
,则该溶液的pH一定为![]()
C.![]()
![]()
![]() 溶液中的
溶液中的![]() 是
是![]()
![]()
![]() 溶液中的
溶液中的![]() 的2倍
的2倍
D.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CO还原脱硝技术可有效降低烟气中的NOx的排放量。
(1)汽车在行驶过程中会产生有害气体CO、NO,在催化剂作用下发生如下脱硝反应:![]() ,该反应平衡常数的表达式K=______________,在570 K时,K值极大,为1×1059,但汽车上仍需装备尾气处理装置,其可能原因是________________。
,该反应平衡常数的表达式K=______________,在570 K时,K值极大,为1×1059,但汽车上仍需装备尾气处理装置,其可能原因是________________。
(2)以Mn3O4 为脱硝反应的催化剂,研究者提出如下反应历程,将历程补充完整。
第一步:___________________________________;
第二步:![]()
(3)T℃、2L密闭容器中,充入各1mol的CO和NO混合气体,加入Mn3O4发生脱硝反应,t0 时达到平衡,测得反应过程中CO2的体积分数与时间的关系如下图所示:
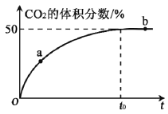
①比较大小:a处v正______b处v逆(填“>”、“<”或“=”)
②若t0 =10min,反应从开始到达平衡CO气体的平均反应速率v( CO) =_____。
③NO的平衡转化率为______,T℃时反应的化学平衡常数K=_________。
④T℃时,某时刻测得体系中各物质的量如下:n(CO)=0.2mol,n(NO)=0.2mol,n(N2)=0.1mol,n(CO2)=0.2mol,则此时该反应_______进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是
A.前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.在2 s时,体系内压强为反应前的1.1倍
C.平衡时,体系内含N2O40.25 mol
D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某实验小组探究碳酸氢铵溶液中各微粒物质的量浓度随溶液pH的变化如图所示(忽略溶液体积变化),则下列说法错误的是( )
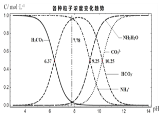
A.由图可知碳酸的Ka1数量级约为10-7
B.向NH4HCO3溶液加入与NH4HCO3等物质的量NaOH的溶液,HCO3-会先与NaOH反应
C.常温下将NH4HCO3固体溶于水,溶液显碱性
D.NH4HCO3作肥料时不能与草木灰混用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42-从右向左移动。下列分析正确的是

A.溶液中A2+浓度减小
B.B 的电极反应: B-2eˉ=B2+
C.y 电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.水是极弱的电解质,它能微弱电离生成相同物质的量的H+和OH-
B.稀溶液中c(H+)c(OH-)=KW,任何条件下KW都保持不变
C.无论在什么条件下,中性溶液的c(H+)一定等于1×10-7mol/L
D.H2O![]() H++OH-是一吸热反应,所以温度升高,KW也随之减小
H++OH-是一吸热反应,所以温度升高,KW也随之减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是生活中常用的消毒剂,可与硫酸反应制取氯气,反应原理为NaClO+NaCl+H2SO4![]() Na2SO4+Cl2↑+H2O,为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
Na2SO4+Cl2↑+H2O,为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
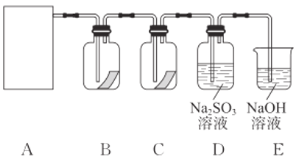
(1)上述制备氯气的反应中,每生成1molCl2,转移的电子的物质的量是________mol。
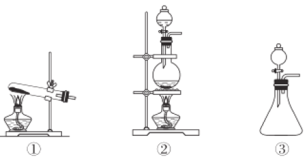
(2)依据上述反应原理,从下列装置中选择合适的制氯气装置(A处)________(填序号)。
(3)装置B、C中依次盛放的是干燥的红色布条和湿润的红色布条,其目的是________。实验过程中该同学发现装置B中的布条也褪色,说明该装置存在明显的缺陷,改进的方法是________。
(4)E中NaOH溶液吸收氯气时发生反应的化学方程式是________。
(5)D中氯气可将![]() 氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是________(写出操作、试剂和现象)。
氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是________(写出操作、试剂和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在101kPa、25℃条件下,2 mol氢气完全燃烧生成水蒸气放出484kJ的热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+![]() O2(l) △H=+242kJ/mol
O2(l) △H=+242kJ/mol
B.2H2 (g)+O2(g)=2H2O(l) △H=-484kJ/mol
C.H2(g)+![]() O2(g)=H2O(g) △H=-242kJ/mol
O2(g)=H2O(g) △H=-242kJ/mol
D.2H2(g)+O2(g)=2H2O(g) △H=+484kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
①![]() 分子中既含极性键又含非极性键
分子中既含极性键又含非极性键
②若![]() 和
和![]() 的电子层结构相同,则原子序数:
的电子层结构相同,则原子序数:![]()
③![]() 、
、![]() 、
、![]() 、
、![]() 熔点随相对分子质量的增大而升高
熔点随相对分子质量的增大而升高
④![]() 、
、![]() 、
、![]() 、
、![]() 分子中各原子均达到
分子中各原子均达到![]() 稳定结构
稳定结构
⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥![]() 分子很稳定是由于
分子很稳定是由于![]() 分子之间能形成氢键
分子之间能形成氢键
⑦由于非金属性:![]() ,所以酸性:
,所以酸性:![]()
A.②⑤⑥⑦B.①③④⑤C.②④⑤D.③⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com