
【题目】常温下,0.1 mol·L1 H2R溶液中H2R、HR、R2三者中所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列表述正确的是

A. Na2R溶液中:c(Na+)=c(HR)+2c(R2)
B. H2R![]() H++HR,Ka1=1.0×101.3
H++HR,Ka1=1.0×101.3
C. 等物质的量的NaHR和Na2R溶于水,使得溶液pH恰好为4.3
D. HF的Ka=1.0×103.4,在足量NaF溶液中加入少量H2R,发生反应:H2R+2F![]() 2HF+R2
2HF+R2
【答案】B
【解析】R2水解溶液呈碱性,c(OH)>c(H+),根据电荷守恒:c(Na+)+c(H+)=c(OH)+c(HR)+2c(R2),则c(Na+)>c(HR)+2c(R2),A项错误;电离常数只与温度有关,由图像知,当c(H2R)=c(HR)时,pH=1.3,H2R![]() H++HR,Ka1=[c(H+)·c(HR)]/c(H2R)=c(H+)=1.0×101.3,B项正确;同理可知,Ka2=1.0×104.3,等物质的量的NaHR和Na2R溶于水所得溶液呈酸性,故溶液中的c(R2)>c(HR),c(H+)<1.0×104.3 mol·L1,溶液的pH>4.3,C项错误;HF的电离常数大于H2R的电离常数Ka2,而小于Ka1,由强酸制弱酸原理可知,离子方程式为H2R+F
H++HR,Ka1=[c(H+)·c(HR)]/c(H2R)=c(H+)=1.0×101.3,B项正确;同理可知,Ka2=1.0×104.3,等物质的量的NaHR和Na2R溶于水所得溶液呈酸性,故溶液中的c(R2)>c(HR),c(H+)<1.0×104.3 mol·L1,溶液的pH>4.3,C项错误;HF的电离常数大于H2R的电离常数Ka2,而小于Ka1,由强酸制弱酸原理可知,离子方程式为H2R+F![]() HF+HR,D项错误。
HF+HR,D项错误。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积![]() 的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液
的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液![]() 与pH的变化关系如图所示,则( )
与pH的变化关系如图所示,则( )
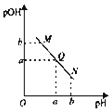
A.M点所示溶液的导电能力强于Q
B.M点的溶液显碱性,N点溶液显酸性
C.M点和N点所示溶液中水的电离程度相同
D.Q点溶液的pH一定为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,水的离子积约为1×10-12,将VaL pH=2的硫酸溶液与VbL pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va∶Vb为 ( )
A. 2∶11B. 2∶9C. 11∶2D. 9∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为___。
(2)“碱浸”过程中发生的离子方程式是___。
(3)“酸浸”时所加入的酸是___(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是___。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是___。
(5)“调pH为2~3”的目的是___。
(6)产品晶体中有时会混有少量绿矾(FeSO47H2O),其原因可能是__ 、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
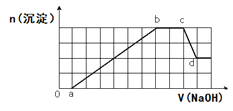
A.d点溶液中含有的溶质只有Na2SO4
B.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓, Mg2++2OH-= Mg(OH)2↓
C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+
D.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
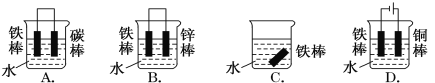
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
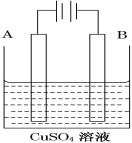
①铁件应与电源的________极相连(写正或负),B电极的电极反应式是______。
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为10.24 g,则电镀时电路中通过的电子为________mol。
③电镀结束后CuSO4溶液的浓度______(填变大,变小,不变)
④镀层破损后,铁不易被腐蚀的是___________(填序号)。
A 镀铜铁 B 镀锌铁 C 镀锡铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在1 L的密闭容器中充入2 mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是 ( )
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是 ( )
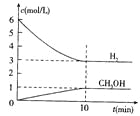
A.0~10min内v(H2)=0.3mol/(L·min)
B.T℃时,平衡常数K=![]() ,CO2和H2的转化率相等
,CO2和H2的转化率相等
C.T℃时,上述反应中有64g CH3OH生成,同时放出98.0kJ的热量
D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com