
【题目】溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
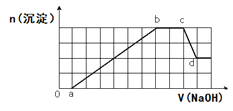
A.d点溶液中含有的溶质只有Na2SO4
B.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓, Mg2++2OH-= Mg(OH)2↓
C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+
D.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
【答案】D
【解析】
A.根据图象第一段,沉淀不是马上出现,可知一定有氢离子,生成沉淀在后面溶解一部分,一定有铝离子,所以d点溶液中的溶质除了Na2SO4,还含有Na[Al(OH)4],故A项错误;
B. Al3+不与HCO3共存,所以一定不含HCO3,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,一定不含镁离子,所以ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓,Fe3++3OH-= Fe(OH)3↓,故B错误;
C.Al3+不与HCO3共存,所以一定不含HCO3,根据第三段,和氢氧化钠反应的离子不产生沉淀,证明是铵根离子,根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了一体积的氢氧化钠,所以形成氢氧化铝用了三体积的氢氧化钠,还有三体积的氢氧化钠一定是被三价铁离子消耗,所以一定含有三价铁离子,一定不含镁离子,即原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,故C项错误;
D.根据坐标得生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解用了1体积的氢氧化钠,所以形成氢氧化铝用了3体积的氢氧化钠,还有3体积的氢氧化钠一定是被三价铁离子消耗,原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,故D项正确;
故答案选D。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
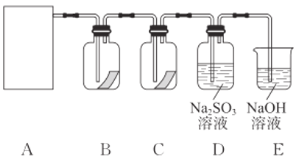
【题目】“84消毒液”是生活中常用的消毒剂,可与硫酸反应制取氯气,反应原理为NaClO+NaCl+H2SO4![]() Na2SO4+Cl2↑+H2O,为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
Na2SO4+Cl2↑+H2O,为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
(1)上述制备氯气的反应中,每生成1molCl2,转移的电子的物质的量是________mol。
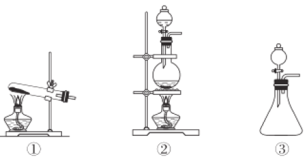
(2)依据上述反应原理,从下列装置中选择合适的制氯气装置(A处)________(填序号)。
(3)装置B、C中依次盛放的是干燥的红色布条和湿润的红色布条,其目的是________。实验过程中该同学发现装置B中的布条也褪色,说明该装置存在明显的缺陷,改进的方法是________。
(4)E中NaOH溶液吸收氯气时发生反应的化学方程式是________。
(5)D中氯气可将![]() 氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是________(写出操作、试剂和现象)。
氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是________(写出操作、试剂和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
Ⅰ.已知:2CO(g) + O2(g)=2CO2(g) ΔH=-566 kJ/mol
2Fe(s) + 3/2O2(g)=Fe2O3(s) ΔH=-825.5 kJ/mol
反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
Ⅱ.反应1/3Fe2O3(s)+CO(g)![]() 2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
(1)CO的平衡转化率为 __________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 _________。
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下与H2反应制备甲醇: CO(g)+2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
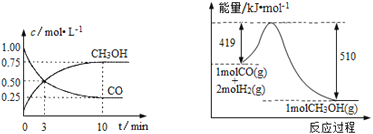
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率υ(H2)=_____________。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物 转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
甲 | 1 molCO和2 molH2 | α1 | c1 | 放出Q1 kJ热量 |
乙 | 1 molCH3OH | α2 | c2 | 吸收Q2 kJ热量 |
丙 | 2 molCO和4 molH2 | α3 | c3 | 放出Q3 kJ热量 |
则下列关系正确的是 _________(填序号)。
A.c1=c2;B.2Q1=Q3;C.2α1=α3;D.α1+α2=1;E.该反应若生成1 molCH3OH,则放出(Q1+Q2)kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
①![]() 分子中既含极性键又含非极性键
分子中既含极性键又含非极性键
②若![]() 和
和![]() 的电子层结构相同,则原子序数:
的电子层结构相同,则原子序数:![]()
③![]() 、
、![]() 、
、![]() 、
、![]() 熔点随相对分子质量的增大而升高
熔点随相对分子质量的增大而升高
④![]() 、
、![]() 、
、![]() 、
、![]() 分子中各原子均达到
分子中各原子均达到![]() 稳定结构
稳定结构
⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键
⑥![]() 分子很稳定是由于
分子很稳定是由于![]() 分子之间能形成氢键
分子之间能形成氢键
⑦由于非金属性:![]() ,所以酸性:
,所以酸性:![]()
A.②⑤⑥⑦B.①③④⑤C.②④⑤D.③⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L1 H2R溶液中H2R、HR、R2三者中所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列表述正确的是

A. Na2R溶液中:c(Na+)=c(HR)+2c(R2)
B. H2R![]() H++HR,Ka1=1.0×101.3
H++HR,Ka1=1.0×101.3
C. 等物质的量的NaHR和Na2R溶于水,使得溶液pH恰好为4.3
D. HF的Ka=1.0×103.4,在足量NaF溶液中加入少量H2R,发生反应:H2R+2F![]() 2HF+R2
2HF+R2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构
B.高聚物![]() 的单体可以通过乙烯和HCl加成制得
的单体可以通过乙烯和HCl加成制得
C.(CH3)2CH﹣CH=CH﹣C(CH3)3与氢气加成后的产物用系统命名法命名为2,2,5﹣三甲基己烷
D.完全燃烧一定质量的冰醋酸、葡萄糖混合物(以任意质量比混合),生成CO2和H2O的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.用石墨作阴极、铜作阳极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3 ↓+NH3·H2O
C.含0.1 mol FeI2的溶液中滴加含0.1 mol Cl2的氯水:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.酸性KMnO4溶液与双氧水反应:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,下列叙述正确的是
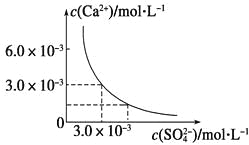
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对在密闭容器中进行的可逆反应:4NH3(g)+5O2![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=1∶1
B.反应达到平衡后,再向体系中充入O2,将提高NH3的转化率
C.反应达到平衡时,若向体系中充入稀有气体,速率增大
D.当v正(NH3):v正(NO)=1∶1时,说明该化学反应已经达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com