
【题目】对在密闭容器中进行的可逆反应:4NH3(g)+5O2![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=1∶1
B.反应达到平衡后,再向体系中充入O2,将提高NH3的转化率
C.反应达到平衡时,若向体系中充入稀有气体,速率增大
D.当v正(NH3):v正(NO)=1∶1时,说明该化学反应已经达到平衡
科目:高中化学 来源: 题型:
【题目】溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
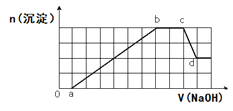
A.d点溶液中含有的溶质只有Na2SO4
B.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓, Mg2++2OH-= Mg(OH)2↓
C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+
D.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是( )
A.配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1,则可证明醋酸是弱电解质
C.取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质
D.测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题。
(1)羟基的电子式__________ ,(CH3)3COH的名称__________(系统命名法)
(2)从下列物质中选择对应类型的物质的序号填空。
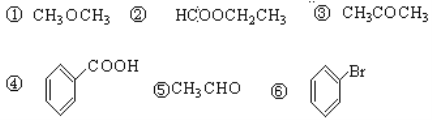
酸:_________ 酯:_________ 醚:_________ 酮:_________
(3)下列各组物质:
① O2和O3 ②乙醇和甲醚;③ 淀粉和纤维素;④ 苯和甲苯;⑤ 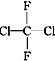 和
和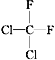 ;⑥
;⑥ ![]() 和
和![]() ;⑦ CH3CH2NO2和
;⑦ CH3CH2NO2和![]()
A.互为同系物的是___________, B.互为同分异构体的是__________,C.属于同一种物质的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在1 L的密闭容器中充入2 mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是 ( )
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是 ( )
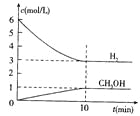
A.0~10min内v(H2)=0.3mol/(L·min)
B.T℃时,平衡常数K=![]() ,CO2和H2的转化率相等
,CO2和H2的转化率相等
C.T℃时,上述反应中有64g CH3OH生成,同时放出98.0kJ的热量
D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某同学探究Na2SO3溶液和铬(VI)盐溶液反应规律的实验记录,已知:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+
2CrO42-(黄色)+ 2H+
序号 | a | b | 现象 | |
| 1 | 2 mL 0.05 mol·L1 K2Cr2O7溶液(pH = 2) | 3滴饱和Na2SO3溶液(pH = 9) | 溶液变绿色(含Cr3+) |
2 | 2 mL 0.1 mol·L1 K2CrO4溶液(pH = 8) | 3滴饱和Na2SO3溶液 | 溶液没有明显变化 | |
3 | 2 mL饱和Na2SO3溶液 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变黄色 | |
4 | 2 mL蒸馏水 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变成浅橙色 |
下列说法不正确的是
A. 实验1中的绿色溶液中含有SO42-
B. 实验1、2的a溶液中所含的离子种类相同
C. 向实验3溶液中继续滴加过量硫酸可使溶液变为浅橙色
D. 实验4的目的是排除稀释对溶液颜色变化造成的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下反应4A(s)+3B(g)2C(g)+D(g)经2min B的浓度减少0.6molL-1,对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4molL-1min-1
B.分别用B、C、D表示反应的速率,其比值是1:2:3
C.2min末的反应速率v(B)=0.3molL-1min-1
D.在2min内用B和C表示的正反应速率的值都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)xC(g),符合如图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )
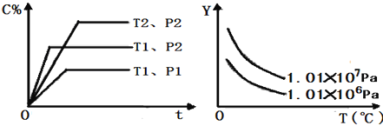
A.反应物A的百分含量B.平衡混合气体中物质B的百分含量
C.平衡混合气体的密度D.平衡混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水含有![]() 和
和![]() 等离子,需经污水处理达标后才能排放,污水处理拟用如图流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理拟用如图流程进行处理:
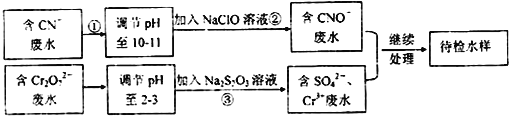
回答下列问题:
![]() 步骤
步骤![]() 中,
中,![]() 被
被![]() 氧化为
氧化为![]() 的离子方程式为 ______ .
的离子方程式为 ______ .
![]() 步骤
步骤![]() 的反应方程式为
的反应方程式为![]() 未配平
未配平![]() ,则每消耗
,则每消耗![]()
![]() ,反应中
,反应中![]() 失去
失去![]() ______ mo1.
______ mo1.
![]() 含
含![]() 废水可以加入熟石灰进一步处理,目的是 ______ .
废水可以加入熟石灰进一步处理,目的是 ______ .
![]() 在
在![]() 下,将a
下,将a![]() 的NaCN溶液与
的NaCN溶液与![]() 的盐酸等体积混合,反应后测得溶液
的盐酸等体积混合,反应后测得溶液![]() ,用含a的代数式表示
,用含a的代数式表示![]() 的水解常数
的水解常数![]() ______
______ ![]() 若
若![]() 时将浓度均为
时将浓度均为![]() 的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是 ______
的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是 ______ ![]() 填字母
填字母![]() .
.
![]() 此溶液一定有
此溶液一定有![]()
![]() 此溶液一定有
此溶液一定有![]()
C 混合溶液中水的电离程度一定大于该温度下纯水的电离程度
![]() 此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
![]() 利用
利用![]() 通过下列方法测定某锡粉的纯度
通过下列方法测定某锡粉的纯度![]() 杂质不参与反应
杂质不参与反应![]() :取ag锡粉溶于盐酸中,向生成的
:取ag锡粉溶于盐酸中,向生成的![]() 中加入过量的
中加入过量的![]() 溶液,用b
溶液,用b![]()
![]() 滴定生成的
滴定生成的![]() 已知酸性环境下,
已知酸性环境下,![]() 可被还原为
可被还原为![]() ,共用去
,共用去![]() 溶液m
溶液m![]() 则锡粉中锡的质量分数是 ______
则锡粉中锡的质量分数是 ______ ![]() 的摩尔质量为M
的摩尔质量为M![]() ,用含a、b、m、M的代数式表示
,用含a、b、m、M的代数式表示![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com