
【题目】下列离子方程式书写正确的是( )
A.用石墨作阴极、铜作阳极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3 ↓+NH3·H2O
C.含0.1 mol FeI2的溶液中滴加含0.1 mol Cl2的氯水:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.酸性KMnO4溶液与双氧水反应:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O
【答案】B
【解析】
A. 铜作阳极电解饱和食盐水时,阳极上Cu放电,Cl-不放电;
B. 0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合,生成硫酸钡和氢氧化铝沉淀及NH3·H2O;
C. 还原性I->Fe2+,据此判断发生的反应;
D. 电荷不守恒。
A. 铜作阳极电解饱和食盐水时,阳极上Cu放电,反应生成氢氧化铜和氢气,反应为:Cu+2H2O![]() Cu(OH)2↓+H2↑,A项错误;
Cu(OH)2↓+H2↑,A项错误;
B. 0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合,生成硫酸钡和氢氧化铝沉淀及NH3·H2O,离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3 ↓+NH3·H2O,B项正确;
C. 还原性I->Fe2+,因此Cl2先氧化I-,当所有的I-都被氧化后再氧化Fe2+,向含0.1 molFeI2的溶液中滴加含0.1 mol Cl2的氯水,只有I-被氧化,因此离子方程式为:2I-+Cl2=I2+2Cl-,C项错误;
D. 酸性KMnO4溶液与双氧水反应,离子方程式为:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】已知25 ℃时弱电解质的电离平衡常数: Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。将20 mL 0.10 mol·L-1CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图所示。反应开始时,两种溶液产生CO2的速率明显不同的原因是___________
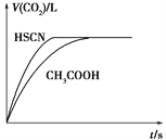
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
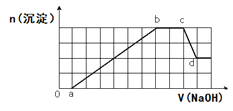
A.d点溶液中含有的溶质只有Na2SO4
B.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓, Mg2++2OH-= Mg(OH)2↓
C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+
D.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
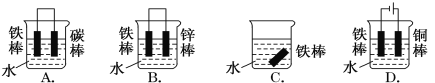
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
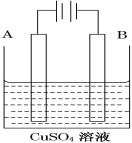
①铁件应与电源的________极相连(写正或负),B电极的电极反应式是______。
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为10.24 g,则电镀时电路中通过的电子为________mol。
③电镀结束后CuSO4溶液的浓度______(填变大,变小,不变)
④镀层破损后,铁不易被腐蚀的是___________(填序号)。
A 镀铜铁 B 镀锌铁 C 镀锡铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g)2C(g),已知起始投入4molA(g)和2molB(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变,下列说法正确的是( )
A.2s内用物质A表示的平均反应速率为0.6mol/(L·s)
B.2s内用物质B表示的平均反应速率为0.6mol/(L·s)
C.2s后每有0.6mol的物质B生成,同时就有0.6mol物质C生成
D.反应前后的压强比为10:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了说明醋酸是弱电解质,某同学设计了如下实验方案证明,其中错误的是( )
A.配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1,则可证明醋酸是弱电解质
C.取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质
D.测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下反应4A(s)+3B(g)2C(g)+D(g)经2min B的浓度减少0.6molL-1,对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4molL-1min-1
B.分别用B、C、D表示反应的速率,其比值是1:2:3
C.2min末的反应速率v(B)=0.3molL-1min-1
D.在2min内用B和C表示的正反应速率的值都是逐渐减小的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com