
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
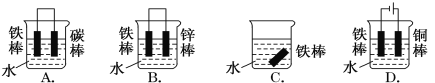
(1)下列哪个装置可防止铁棒被腐蚀________________。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
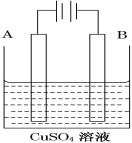
①铁件应与电源的________极相连(写正或负),B电极的电极反应式是______。
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为10.24 g,则电镀时电路中通过的电子为________mol。
③电镀结束后CuSO4溶液的浓度______(填变大,变小,不变)
④镀层破损后,铁不易被腐蚀的是___________(填序号)。
A 镀铜铁 B 镀锌铁 C 镀锡铁
【答案】BD 负 Cu2++2e_= Cu 0.16 不变 B
【解析】
在铁件上镀铜时,铜作阳极,与正极相连,铁件作阴极,Cu2+得电子生成Cu:Cu2++2e-=Cu,镀层破损后,镀铜铁形成的原电池中铁作负极,腐蚀加快,镀锌铁形成的原电池中铁作正极被保护。
(1)铁作原电池的正极或电解池的阴极时可防止被腐蚀,B为原电池,锌作负极被腐蚀,铁作正极被保护,D为电解池,铁与电源的负极相连,作阴极被保护;
故答案为 BD
(2)①在铁件上镀铜时,铜作阳极,与正极相连,铁棒作阴极,B电极为阴极,阴极发生还原反应,Cu2+得电子生成Cu:Cu2++2e-=Cu;
②A极为阳极,发生氧化反应阳极反应离子方程式:Cu-2e-=Cu2+,故阳极固体质量减少,阴极固体质量增加,二者质量差为10.24 g,则阴极表面增加的铜的质量为5.12g,转换为物质的量为0.08mol,已知每生成1mol铜转移2mol电子,故电路中通过的电子为0.16mol;
③A极为阳极,发生氧化反应阳极反应离子方程式:Cu-2e-=Cu2+,这样溶液中Cu离子的浓度就不会改变;
④镀层破损后,镀铜铁、镀锡铁形成的原电池中铁作负极,腐蚀加快,镀锌铁形成的原电池中铁作正极被保护;
故答案为负 Cu2++2e-= Cu 0.16 不变 B。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】化学反应中不仅有物质变化而且伴随着能量变化。
(1)以下实验中属于吸热反应的是________(填序号)。

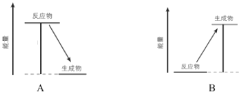
(2)下图中,表示放热反应能量变化的是_______(填字母)。
(3)从微观角度分析化学反应中能量变化的原因:
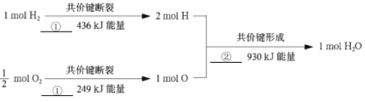
图中①和②分别为_______、_______(填“吸收”或“释放”)。氢气与氧气反应生成1mol水蒸气时,释放________kJ能量。
(4)当前,很多地区倡导用天然气替代煤作为家用燃料,根据下表从尽可能多的角度分析其原因是__。
燃料 | 燃烧释放的能量(每1千克) |
天然气 | 55812kJ |
煤 | 20908kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法不正确的是
A.标况下,3.2g N2H4中含有的N-H键的数目为0.4NA
B.Cu与浓硝酸反应生成4.6 g NO2和N2O4混合气体时,转移的电子数为0.1NA
C.2 mol的CO2和H2O(g)的混合气体与过量Na2O2充分反应生成气体的分子数为NA
D.将1 mol Cl2通入足量水中,HClO、Cl-、ClO-的粒子数之和为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L1 H2R溶液中H2R、HR、R2三者中所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列表述正确的是

A. Na2R溶液中:c(Na+)=c(HR)+2c(R2)
B. H2R![]() H++HR,Ka1=1.0×101.3
H++HR,Ka1=1.0×101.3
C. 等物质的量的NaHR和Na2R溶于水,使得溶液pH恰好为4.3
D. HF的Ka=1.0×103.4,在足量NaF溶液中加入少量H2R,发生反应:H2R+2F![]() 2HF+R2
2HF+R2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,将
时,将![]() 的盐酸与b
的盐酸与b![]() 的氨水等体积混合,反应后溶液呈中性
的氨水等体积混合,反应后溶液呈中性![]() 忽略溶液混合后体积的变化
忽略溶液混合后体积的变化![]() 下列说法不正确的是
下列说法不正确的是![]()
A.此时水的电离程度并不是最大
B.混合溶液中的离子浓度:![]()
C.此时溶液中![]() 的浓度为
的浓度为![]()
D.用含b的代数式不能表示![]() 时
时![]() 的电离常数
的电离常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.用石墨作阴极、铜作阳极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3 ↓+NH3·H2O
C.含0.1 mol FeI2的溶液中滴加含0.1 mol Cl2的氯水:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.酸性KMnO4溶液与双氧水反应:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表提供的数据,下列判断正确的是![]()
化学式 | 电离常数 |
HF |
|
|
|
| |
HClO |
|
A.同温同浓度下,溶液的pH值:![]()
B.结合![]() 的能力:
的能力:![]()
C.碳酸钠溶液中加入少量氢氟酸的离子方程式:![]()
D.次氯酸钠溶液中通入少量二氧化碳的离子方程式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
2A(g)![]() B(g)+C(g);ΔH =-48.25 kJ·mol-1,反应过程中B、A的浓度比与时间t有下图所示关系,若测得第15min时c(B)=1.6 mol·L-1,下列结论正确的是
B(g)+C(g);ΔH =-48.25 kJ·mol-1,反应过程中B、A的浓度比与时间t有下图所示关系,若测得第15min时c(B)=1.6 mol·L-1,下列结论正确的是
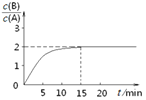
A.该温度下此反应的平衡常数为3.2
B.A的初始物质的量为4 mol
C.反应到达平衡时,放出的热量是193kJ
D.反应达平衡时,A的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中,2molX和2molY进行如下反应:2X(g)+Y(g)Z(g),经2min达到平衡,生成0.6molZ。下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.06mol/(Lmin)
B.将容器体积变为20L,Z的平衡浓度为原来的![]()
C.平衡时,X的转化率为30%
D.起始状态和平衡时容器内的气体压强比为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com