
【题目】设NA为阿伏加德罗常数的数值。下列说法不正确的是
A.标况下,3.2g N2H4中含有的N-H键的数目为0.4NA
B.Cu与浓硝酸反应生成4.6 g NO2和N2O4混合气体时,转移的电子数为0.1NA
C.2 mol的CO2和H2O(g)的混合气体与过量Na2O2充分反应生成气体的分子数为NA
D.将1 mol Cl2通入足量水中,HClO、Cl-、ClO-的粒子数之和为2NA
【答案】D
【解析】
A、N2H4的结构式为![]() ,3.2g N2H4的物质的量为0.1mol,所以含有N-H键的数目为0.4NA,故A正确;
,3.2g N2H4的物质的量为0.1mol,所以含有N-H键的数目为0.4NA,故A正确;
B、4.6 g NO2和N2O4含有0.1N,所以生成4.6 g NO2和N2O4时得到0.1mol电子,所以转移电子数为0.1NA,故B正确;
C、根据过氧化钠与水或二氧化碳反应的方程式可知,当2mol过氧化钠反应时,均消耗2mol的水或二氧化碳,产生1mol氧气,所以2 mol的CO2和H2O(g)的混合气体与过量Na2O2充分反应生成气体的分子数为NA,故C正确;
D、氯水中含有的粒子有HClO、Cl-、ClO-、Cl2、H+、OH-、H2O,所以1 mol Cl2通入足量水中,HClO、Cl-、ClO-的粒子数之和小于2NA,故D错误;
故选D。


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】异丁烯与氯化氢可能发生的两种加成反应及相应的能量变化与反应过程如下图所示,下列说法错误的是( )


A.活化能:反应①大于反应②
B.中间产物的稳定性:中间体1小于中间体2
C.产物的能量:产物1大于产物2
D.△H大小:反应①小于反应②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
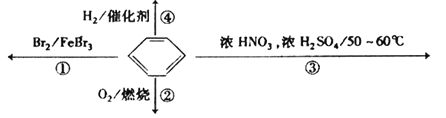
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某气态氧化物的化学式为RO2,在标准状况下,1.28g该氧化物的体积为448mL则该R摩尔质量为___。
(2)已知CO、SO2的混合气体质量共18.4g,标准状况下体积为8.96L,则可推知该混合气体中CO的物质的量分数为____,混合气体的平均相对分子质量为____。
(3)同温同压下,SO2与氢气的密度之比为____;若体积相同时,两种气体的质量比为____。
(4)质量比为51∶28的NH3、CO所含质子数之比为____。
(5)标准状况下,aL气体X2和bL气体Y2恰好完全反应生成cL气体Z,若2a=6b=3c,则Z的化学式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置模拟制备碳酸镧。
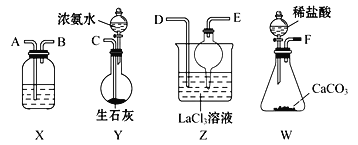
(1)盛放稀盐酸的仪器名称为________________。
(2)制备碳酸镧实验流程中导管从左向右的连接顺序为F→____→____→____→____→______。
(3)W中发生反应的离子方程式为_______Y中发生反应的化学反应方程式为__________
(4)X中盛放的试剂是_________,干燥管的作用为_________________。
(5)Z中通入气体的方式________
A.先通入足量NH3,后通入过量的CO2
B.先通入足量CO2,后通入过量的NH3
C.NH3和CO2同时通入
(6)该化学兴趣小组为探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为________________,实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,则关于两种物质稳定性实验结论为_____。
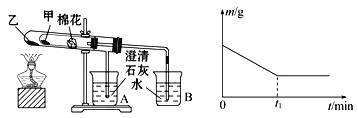
A.稳定性La2(CO3)3>La(HCO3)3
B.稳定性La2(CO3)3<La(HCO3)3
C.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列说法正确的是
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c
B.KNO3溶液和CH3OOONH4溶液pH均为7,但两溶液中水的电离程度不相同
C.5.0×10-3 mol·L-1KHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A)
D.己知某分散系中存在:M(OH)2(s)![]() M2+(aq)+2OH-(aq),K=a,c(M2+)=b mol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq),K=a,c(M2+)=b mol·L-1时,溶液的pH等于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在474.8g水中溶解25.2g草酸晶体(H2C2O4·2H2O,相对分子质量为126),得到一份草酸浓溶液,该溶液密度为2.0g/cm3。
(1)以上过程得到的草酸浓溶液的物质的量浓度为___mol/L。
(2)现需用上述浓溶液配制0.1mol/L的草酸溶液450mL。
①实验中用到的玻璃仪器有胶头滴管、烧杯、量筒、___。
②应量取浓溶液的体积为___mL。
③下列情况中,会导致配制的0.1mol/L的草酸溶液浓度偏高的有___(填字母)。
A.配制浓溶液所使用的草酸晶体失去部分结晶水
B.使用“左码右物”的方法称量草酸晶体
C.容量瓶未经干燥就使用
D.量取浓溶液时仰视刻度线
(3)H2C2O4·2H2O受热易分解,分解产物均为氧化物,其中一种产物能使澄清石灰水变浑浊,请写出H2C2O4·2H2O受热分解的化学方程式___。
(4)用移液管量取10.00mL酸性K2Cr2O7溶液,恰好与20.00mL0.1mol/L的草酸溶液反应,还原产物为Cr3+,氧化产物为CO2。在此实验中,草酸体现___性;此酸性K2Cr2O7溶液的物质的量浓度为___mol/L(保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需量取该浓硫酸______mL。
(2)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、胶头滴管、____________。
(3)使用容量瓶前必须进行的一步操作是____________。
(4)要从所配溶液中取出10 mL稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(5)下列操作会使所配溶液浓度偏低的是__________。
A. 用量筒量取浓硫酸,读数时仰视刻度线
B. 转移溶液时未洗涤烧杯
C. 定容时俯视容量瓶的刻度线
D. 定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.2 mol·L-1
B. 通入CO2在标准状况下的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com