
【题目】室温下,下列说法正确的是
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c
B.KNO3溶液和CH3OOONH4溶液pH均为7,但两溶液中水的电离程度不相同
C.5.0×10-3 mol·L-1KHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A)
D.己知某分散系中存在:M(OH)2(s)![]() M2+(aq)+2OH-(aq),K=a,c(M2+)=b mol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq),K=a,c(M2+)=b mol·L-1时,溶液的pH等于![]()
科目:高中化学 来源: 题型:
【题目】某烃的含氧衍生物的球棍模型如图所示(图中球与球之间连线代表化学键单键或双键)。下列关于该有机物的说法正确的是( )
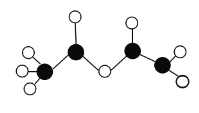
A.该有机物的名称是乙酸乙酯
B.该有机物能使Br2的CCl4或酸性高锰酸钾褪色,原理相同
C.该有机物能发生取代反应、氧化反应和消去反应
D.该有机物的同分异构体中能与NaHCO3反应产生气体的链状结构只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备纳米Fe3O4,的流程示意图如下:

下列叙述错误的是
A. 为提高步骤①的反应速率,可采取搅拌、升温等措施
B. 步骤②中,主要反应的离子方程式是2Fe3++Fe=3Fe2+
C. 步骤④中,反应完成后剩余的H2O2无需除去
D. 步骤⑤中,“分离”包含的操作有过滤、洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)黑火药爆炸时发生反应:2KNO3+S+3C=K2S+N2↑+3CO2↑,其中被还原的元素是___,被氧化的元素是___。
(2)在反应MnO2+4HCl(浓)![]() MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是___;被氧化的HCl的物质的量为___。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是___;被氧化的HCl的物质的量为___。
(3)在一定条件下,RO3n-和I-发生反应的离子方程式如下:RO3n-+6I-+6H+=R-+3I2+3H2O。该反应中还原剂为___,RO3n-中R元素的化合价是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法不正确的是
A.标况下,3.2g N2H4中含有的N-H键的数目为0.4NA
B.Cu与浓硝酸反应生成4.6 g NO2和N2O4混合气体时,转移的电子数为0.1NA
C.2 mol的CO2和H2O(g)的混合气体与过量Na2O2充分反应生成气体的分子数为NA
D.将1 mol Cl2通入足量水中,HClO、Cl-、ClO-的粒子数之和为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是来自石油的重要有机化工原料。结合以下路线回答:
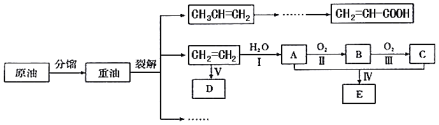
已知:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(1)D是高分子,用来制造包装材料,其结构简式是_____;
(2)反应I的化学方程式是_____;反应II的化学方程式是______;
(3)E有香味,实验室用A和C反应制取E的装置如图所示。
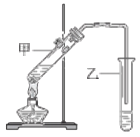
①反应IV的化学方程式是______,其反应类型是____;
②试管乙中用____溶液收集E,分离出试管乙中油状液体需要用到的仪器是___(填序号);
a.漏斗 b.分液漏斗 c.长颈漏斗
③实验结束,振荡试管乙,有无色气泡产生,其主要原因是__________(用化学方程式表示)。
(4)产物CH2=CH-COOH可能发生的反应有____(填序号)。
a.加成反应 b.取代反应 c.氧化反应 d.中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠俗称保险粉,可用于照相业作定影剂、纸浆漂白作脱氯剂等。实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠。本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水。按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热。待烧瓶中固体不再减少时,停止加热。将烧瓶取下,立即趁热过滤,再冷却结晶,抽滤。将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
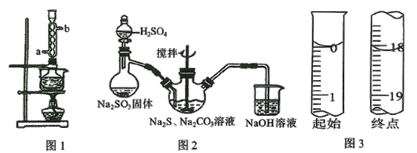
(1)下列说法不正确的是____________。
A.将晶体转移至布氏漏斗时,若器壁上粘有少量晶体,应用冷水淋洗
B.抽滤时,为防止滤纸穿孔,可适当关小水龙头或多加一层滤纸
C.洗涤时,可用一定浓度的乙醇溶液洗涤晶体,目的是洗除晶体表面的杂质,易于得到干燥晶体
D.为加快产品的干燥,可高温烘干
E.在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是_________,三颈烧瓶中发生反应的化学方程式____。
(3)保险粉样品中Na2S2O3·5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用0.1000 mol·L-1碘的标准溶液进行滴定。请回答:
①到达滴定终点的标志______________。
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为__________mL,产品的纯度为______________(设Na2S2O3·5H2O相对分子质量为M)。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的纯度的测量结果___________(填“偏高”、“偏低”或“不变”)。
(4)某研究小组以硫代硫酸钠与硫酸反应来探究外界条件对反应速率的影响,设计实验如下:
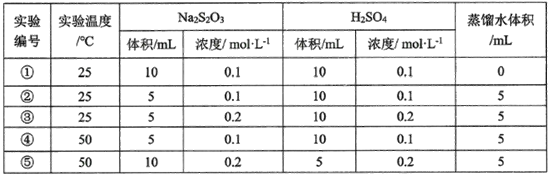
下列有关说法不正确的是__________
A.该同学在实验中采用的研究方法是实验比较法
B实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
C.实验①和③溶液变浑浊的时间相同
D.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把5.1 g铝镁合金的粉末放入100 mL某盐酸中,恰好完全反应,标准状况下收集到5.6 L H2。试计算(注意:无计算过程不给分):
(1)该盐酸的物质的量浓度是多少?_____________
(2)该合金中铝的质量为多少克?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知同温、同浓度时,酸性:H2SO3>H2CO3>HSO3- >HCO3-
【1】用方程式表示NaHSO3溶液中存在的三个平衡体系(不考虑亚硫酸的分解):
①_________、②_________、③_________。
【2】0.1 mol L-1 的 NaHSO3溶液中离子浓度:c(SO32-)______c(HSO3-)(填 “>”、“<”或“=”);要使其中的c(H+)和c(SO32-)都减小,可行的方法是________________。
A 加入过量CaO(s) B 加入少量NaOH(s) C 通入过量HCl(g) D 加入少量的H2O2(aq)
【3】0.1mol L的Na2SO3溶液呈____性(填“酸”、“碱”或“中”),其电荷守恒式: c(Na+)+c(H+)=_______。
【4】H2SO3和NaHCO3溶液的离子方程式为:___________。
【5】NaHSO3溶液在不同温度下均可被过量KIO3酸性溶液氧化,当NaHSO3完全消耗即I2有析出,写出该反应的离子方程式:___________。
【6】将NaHSO3(含少量淀粉)和酸性溶液KIO3(过量)混合,记录10-50℃间溶液变蓝时间,实验結果见下图。请描述曲线变化的规律________。
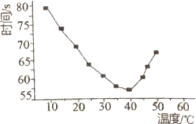
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com