
【题目】把5.1 g铝镁合金的粉末放入100 mL某盐酸中,恰好完全反应,标准状况下收集到5.6 L H2。试计算(注意:无计算过程不给分):
(1)该盐酸的物质的量浓度是多少?_____________
(2)该合金中铝的质量为多少克?_____________
【答案】5mol/L 2.7g
【解析】
镁铝合金与盐酸发生反应的化学方程式为:Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,生成氢气的物质的量为n(H2)=![]() =0.25mol,结合反应的方程式列方程式计算出盐酸的物质的量浓度、合金中铝的质量。
=0.25mol,结合反应的方程式列方程式计算出盐酸的物质的量浓度、合金中铝的质量。
标况下5.6L氢气的物质的量为0.25mol,设5.1g镁铝合金中含有镁物质的量为xmol,含有铝物质的量为ymol,则
Mg+2HCl=MgCl2+H2↑
1 2 1
x 2x x
2Al+6HCl=2AlCl3+3H2↑
2 6 3
y 3y 1.5y
x+1.5y=0.25
24x+27y=5.1
解得:x=0.1;y=0.1
(1)反应消耗的盐酸的总物质的量为:0.1mol×2+0.1mol×3=0.5mol,盐酸的物质的量浓度为:c(HCl)=![]() =5mol/L,
=5mol/L,
故该盐酸的物质的量浓度为5mol/L;
(2)该合金中铝的质量m(Al)=n×M=0.1mol×27g/mol=2.7g
故该合金中铝的质量2.7g。


科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种同体混合物,试回答下列问题:
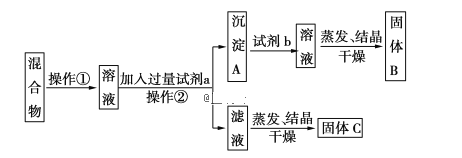
(1)操作①的名称是___________,操作②的名称是__________________。
(2)试剂a是____________(填化学式,下同),固体B是____________。
(3)加入试剂b所发生反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A.将饱和FeCl3溶液滴入沸水中:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+SO42-+H+ =BaSO4↓+H2O
C.碳酸氢钠溶液中加入稀盐酸:CO32-+2H+ =CO2↑+H2O
D.铝与CuSO4溶液反应:Al+Cu2+=Cu+Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行二氧化硫制备与性质实验的组合装置如图所示,部分夹持装置未画出。

请回答下列问题:
(1)在组装好装置后,首先要进行的实验操作为_________________________________。
(2)为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为________,装置D中碱石灰的作用是_______________________________________________。
(3)关闭弹簧夹2,打开弹簧夹1,注入70%的硫酸至浸没三颈烧瓶中的固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是_____________________________________。
(4)关闭弹簧夹1,打开弹簧夹2,残余气体进入装置E、F、G中,能说明I-的还原性弱于SO2的现象为_________________。发生反应的离子方程式是______________________。
(5)为了验证装置E中SO2与FeCl3发生了氧化还原反应,某学生设计了如下实验:取少量装置E中的溶液于试管中,向其中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,并由此判断SO2与FeCl3发生了氧化还原反应。上述方案是否合理?________(填“合理”或“不合理”),原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL H2SO4和CuSO4的混合液中,用石墨作电极进行电解,两极上均收集到2.24 L气体(标准状况下),则原混合液中Cu2+的物质的量浓度为( )
A. 1 mol·L-1 B. 2 mol·L-1 C. 3 mol·L-1 D. 4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值。下列的说法中,正确的是( )
A. 4.6g金属钠由原子完全变为Na+ 离子时,失去的电子数为0.1NA
B. NA 个氧气分子与NA 个氢气分子的质量比为8︰1
C. 0.2 NA个硫酸分子与19.6g磷酸(相对分子质量:98)含有相同的氧原子数
D. 22.4L的氮气所含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是常用的自来水消毒剂。
I.已知实验室可用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+C12 =2C1O2+2NaCl,装置如下图所示:

(1)圆底烧瓶内发生反应的化学方程式是:__________。
(2)已知常温常压下,ClO2和Cl2是气体,在下列溶剂中溶解性如下表所示:
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 溶 |
B、C、E装置中的试剂依次是_________(填序号)。
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
II.使用C1O2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。
(3)Fe2+消除ClO2-的离子方程式为_______。
(4)实际向自来水中加入Fe2+的量要高于理论值,原因是(结合离子方程式解释)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0mol/LKNO3溶液:H+、Fe2+、SCN-、SO42-
B. pH =0的溶液:Al3+、CO32-、Cl-、SO42-
C.![]() 的溶液:K+、Ba2+、NO3-、Cl-
的溶液:K+、Ba2+、NO3-、Cl-
D.无色溶液:Na+、SO32-、Cu2+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是()
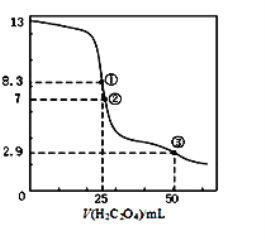
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com