
【题目】某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为___。
(2)“碱浸”过程中发生的离子方程式是___。
(3)“酸浸”时所加入的酸是___(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是___。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是___。
(5)“调pH为2~3”的目的是___。
(6)产品晶体中有时会混有少量绿矾(FeSO47H2O),其原因可能是__ 、___。
【答案】漏斗、蒸发皿 2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑、Al2O3+2OH﹣═2AlO2﹣+H2O H2SO4 Ni2+、Fe2+ 3.2﹣9.2 防止在浓缩结晶过程中Ni2+水解 H2O2的用量不足(或H2O2失效) 保温时间不足导致Fe2+未被完全氧化造成的
【解析】
(1)操作a是过滤,需要使用过滤装置,操作c是蒸发,需要使用蒸发装置;对照两个装置与已知仪器,找出所缺仪器。
(2)“碱浸”过程中是为了除去铝及其氧化物,不管是铝还是氧化铝,与碱液反应都生成偏铝酸盐。
(3)“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备目的是得到NiSO47H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸。
(4)调节溶液pH时,要使铁离子全部沉淀,但镍离子不沉淀。
(5)蒸发浓缩时,要防止镍离子水解,所以需要控制溶液pH在酸性范围。
(6)产品晶体中有时会混有少量绿矾(FeSO47H2O),说明在加入氧化剂时未把亚铁离子全部氧化。
(1)操作a是过滤得到固体和滤液,c是蒸发浓缩得到晶体过滤得到NiSO47H2O;操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为过滤装置中的漏斗和蒸发浓缩溶液需要的蒸发皿;故答案为:漏斗、蒸发皿;
(2)“碱浸”过程中是为了除去铝及其氧化物,铝是两性元素和强碱反应,氧化铝是两性氧化物和强碱反应,镍单质和铁及其氧化物不和碱反应达到除去铝元素的目的;反应的两种方程式为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑、Al2O3+2OH﹣═2AlO2﹣+3H2O;故答案为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑、Al2O3+2OH﹣═2AlO2﹣+H2O;
(3)“酸浸”时主要是溶解镍金属和铁单质及其氧化物,依据制备目的是得到NiSO47H2O,加入的酸不能引入新的杂质,所以需要加入硫酸进行酸浸;镍、铁和稀硫酸反应生成硫酸亚铁、硫酸镍溶液;故答案为:H2SO4;Ni2+、Fe2+;
(4)依据图表中沉淀需要的溶液pH,加入过氧化氢氧化亚铁离子为铁离子后,调节溶液pH使铁离子全部沉淀,镍离子不沉淀得到较纯净的硫酸镍溶液,pH应在3.2﹣9.2间;故答案为:3.2﹣9.2;
(5)硫酸镍溶液需要蒸发浓缩结晶析出,为防止镍离子水解生成氢氧化镍沉淀,需要控制溶液pH在酸性条件下;故答案为:防止在浓缩结晶过程中Ni2+水解;
(6)产品晶体中有时会混有少量绿矾(FeSO47H2O),说明在加入过氧化氢氧化剂氧化亚铁离子时未把亚铁离子全部氧化,氢氧化亚铁沉淀的pH大于镍离子沉淀的pH,保温目的是把亚铁离子完全氧化。故答案为:H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】某课外实验小组利用压强传感器、数据采集器和计算机等数字化实验设备,探究用0.01g镁条分别与2mL不同浓度稀盐酸的反应速率。实验结果如图所示。
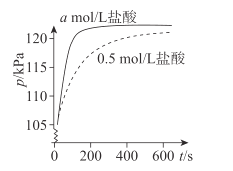
(1)Mg与盐酸反应的离子方程式是________。
(2)从微粒角度分析,该实验是为了探究________(因素)对该反应的化学反应速率的影响。
(3)a________0.5(填“>”或“<”)。
(4)如果用0.5mol/L硫酸代替上述实验中的0.5mol/L盐酸,二者的反应速率是否相同____,请说明原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BeTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__。
(2)用盐酸酸浸时发生反应的离子方程式为:__,为提高酸浸速率,可适当进行加热,但温度不宜过高,原因是__。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有:__。
②简述证明草酸氧化钛钡晶体已洗净的操作及现象__。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:__。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.05mol/L,则c(CO32-)在浸出液中的最大浓度为__mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法不正确的是
A.标况下,3.2g N2H4中含有的N-H键的数目为0.4NA
B.Cu与浓硝酸反应生成4.6 g NO2和N2O4混合气体时,转移的电子数为0.1NA
C.2 mol的CO2和H2O(g)的混合气体与过量Na2O2充分反应生成气体的分子数为NA
D.将1 mol Cl2通入足量水中,HClO、Cl-、ClO-的粒子数之和为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.NA代表阿伏加德罗常数,1mol C4H10中含共价键数目为14NA
B.某反应的ΔH = -88kJmol-1,则正反应活化能一定小于88kJmol-1
C.已知某温度下,Kw = 1×10-13,若将pH =8的NaOH溶液与pH =5的H2SO4溶液混合保持温度不变,欲使混合溶液pH =7,则NaOH溶液与H2SO4溶液的体积比为11:9
D.将浓度为0.1molL-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,![]() 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L1 H2R溶液中H2R、HR、R2三者中所占物质的量分数(分布系数δ)随pH变化的关系如图所示。下列表述正确的是

A. Na2R溶液中:c(Na+)=c(HR)+2c(R2)
B. H2R![]() H++HR,Ka1=1.0×101.3
H++HR,Ka1=1.0×101.3
C. 等物质的量的NaHR和Na2R溶于水,使得溶液pH恰好为4.3
D. HF的Ka=1.0×103.4,在足量NaF溶液中加入少量H2R,发生反应:H2R+2F![]() 2HF+R2
2HF+R2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,将
时,将![]() 的盐酸与b
的盐酸与b![]() 的氨水等体积混合,反应后溶液呈中性
的氨水等体积混合,反应后溶液呈中性![]() 忽略溶液混合后体积的变化
忽略溶液混合后体积的变化![]() 下列说法不正确的是
下列说法不正确的是![]()
A.此时水的电离程度并不是最大
B.混合溶液中的离子浓度:![]()
C.此时溶液中![]() 的浓度为
的浓度为![]()
D.用含b的代数式不能表示![]() 时
时![]() 的电离常数
的电离常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表提供的数据,下列判断正确的是![]()
化学式 | 电离常数 |
HF |
|
|
|
| |
HClO |
|
A.同温同浓度下,溶液的pH值:![]()
B.结合![]() 的能力:
的能力:![]()
C.碳酸钠溶液中加入少量氢氟酸的离子方程式:![]()
D.次氯酸钠溶液中通入少量二氧化碳的离子方程式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应A(g)+3B(g)![]() 2C(g)+2D(g)中,反应速率最快的是
2C(g)+2D(g)中,反应速率最快的是
A.υ(A)=0.02mol/(Ls)B.υ(B)=0.04 mol/(Ls)
C.υ(C)=1.2mol/(Lmin)D.υ(D)=1.8mol/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com