
【题目】一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:
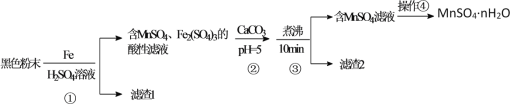
下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
【答案】B
【解析】
黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)用浓硫酸溶解,并加入适量铁粉,过滤后所得滤渣1中主要是不溶于水的炭粉、和置换出的Hg、Pb等,滤液中主要含有MnSO4、Fe2(SO4)3,加入CaCO3并调节溶液pH=5左右,并加热煮沸,促进Fe3+水解生成Fe(OH)3,则过滤后滤渣2主要为Fe(OH)3,滤液主要含有MnSO4,滤液经蒸发浓缩并冷却结晶、过滤即可得到MnSO4nH2O;
A.用Fe和浓H2SO4溶解MnO2时发生反应的化学方程式为2Fe+3MnO2+6H2SO4=3MnSO4+Fe2(SO4)3+6H2O,反应中1molFe参加反应,被还原的MnO2是1.5mol,故A正确;
B.步骤①中同时发生Fe+Hg2+=Fe2++Hg、Fe+Pb2+=Fe2++Pb,则重金属Hg、Pb主要在滤渣1中,故B错误;
C.悬浊液中Fe(OH)3颗粒越大,越易与MnSO4溶液过滤分离,则步骤③煮沸使Fe(OH)3沉淀颗粒长大,目的是便于固液分离,故C正确;
D.锰等是重要金属资源,汞、铅等重金属能来得污染环境,则合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】维生素C的结构简式如图所示:

⑴维生素C分子中—OH原子团的名称是__________________;维生素C__________________溶于水(填“易”或“难”),属于________________ 维生素(填“脂溶性”或“水溶性”)。
⑵维生素C又被称为抗坏血酸,它能促进胶原蛋白形成,所以能防治_____________
⑶一个人每天摄入约100mg维生素C就能满足需要,下列物质中含有丰富维生素C的是____
A.苦瓜 B.鸡蛋 C.豆腐 D.沙丁鱼
⑷“服用维生素C,可使食物中的三价铁离子还原成二价铁离子”这句话说明:维生素C具有_____________性(填“氧化性”或“还原性”);维生素C在这一反应中发生了_____________(填“氧化反应”或“还原反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念,判断下列叙述正确的是![]()
A.![]() 溶于水后能导电,故C
溶于水后能导电,故C![]() 为电解质
为电解质
B.![]() 、
、![]() 、
、![]() 、
、![]() 互为同素异形体
互为同素异形体
C.NaCl溶液和![]() 溶液均显中性,故两溶液中水的电离程度相同
溶液均显中性,故两溶液中水的电离程度相同
D.溶液与胶体本质区别为分散质微粒直径的大小不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的化工原料之一,自20世纪初以来,工业上合成氨主要依赖Haber-Bosch技术。探索新的合成氨的方法一直是重要课题。
(1)最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气。
已知:N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H = -a kJ/mol
H = -a kJ/mol
2H2(g) + O2(g) = 2H2O(1) ![]() H = -b kJ/mol
H = -b kJ/mol
写出上述固氮反应的热化学方程式:_______________。
(2)恒温、恒容条件下,在容器中模拟Haber-Bosch法合成氨,如下图(图中所示数据为初始物理量)。t分钟后反应达到平衡,生成的NH3为0.4 mol。
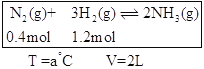
①判断该容器中的反应达平衡的依据是_______(填字母)。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(N2)不随时间改变
d.单位时间内生成2 mol NH3的同时消耗1 mol N2
e.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下容器中反应的平衡常数K=___;平衡时,混合气体压强p平=____(用初始压强p0表示)。
(3)近期,两位希腊化学家提出了电解合成氨的新思路:采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如图:
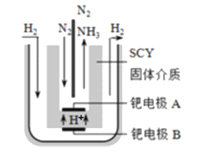
钯电极A是电解池的_____极(填“阳”或“阴”),阴极反应式为________________________________。
(4)合成氨需要纯净的氮气和氢气,在制取原料气的过程中,常混有一些杂质,其中的某些杂质会使合成氨的催化剂“中毒”,所以必须除去。例如,用稀氨水吸收H2S杂质:NH3·H2O + H2S![]()
![]() +HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
+HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种高效净水剂,同时也是高能电池正极的优良材料。已知:K2FeO4 易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学拟用以下装置制备并探究高铁酸钾的性质。
I.K2FeO4的制备,装置如图所示(夹持装置略):
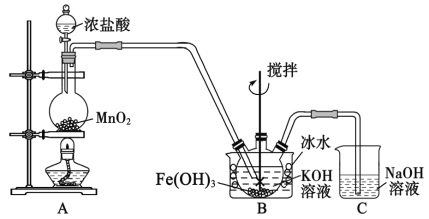

(1)盛放二氧化锰的仪器名称是_______________。
(2)装置B中反应的化学方程式是_______________。
(3)实验时采用冰水浴的原因是___________________,有人提示,将上图装置中的分液漏斗改为如图所示的恒压分液漏斗,其目的是_________________。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,一般用75%乙醇进行洗涤,其目的是__________。
II.K2FeO4性质的探究
查阅资料知,K2FeO4能将Mn2+氧化成![]() ,某实验小组设计如下实验进行验证:
,某实验小组设计如下实验进行验证:
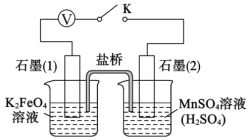
关闭K,发现左烧杯溶液变黄色,右烧杯溶液变紫色。检验左侧烧杯溶液呈黄色的原因,需要的试剂是__________。写出石墨(2)上发生的电极反应式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Mg(OH)2(s) ![]() MgCl2(aq)
MgCl2(aq) ![]() Mg(s)
Mg(s)
B.FeCl2(aq) ![]() FeCl3(aq)
FeCl3(aq) ![]() Fe(OH)3(胶体)
Fe(OH)3(胶体)
C.AgNO3(aq) ![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq) ![]() Ag(s)
Ag(s)
D.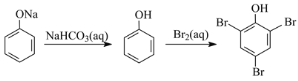
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是巨大的化学资源宝库,人类每年都会从海水中提取很多物质,如图是海水资源综合利用的部分流程。
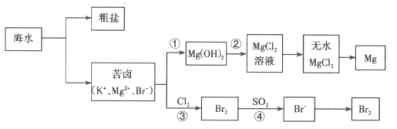
请回答下列问题:
(1)从海水中获取粗盐的方法是___。
(2)步骤①中所加试剂是___,步骤②中发生反应的离子方程式是___。
(3)步骤③中发生反应的离子方程式是___。
(4)步骤④中用“热空气”能从溶液中将Br2吹出的原因是___,用SO2水溶液吸收吹出的Br2时,反应过程中的氧化剂是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大
B.常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b
C.若将适量CO2通入0.1molL-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1molL-1
D.常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:KaKh=Kw
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com