
【题目】氨是最重要的化工原料之一,自20世纪初以来,工业上合成氨主要依赖Haber-Bosch技术。探索新的合成氨的方法一直是重要课题。
(1)最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气。
已知:N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H = -a kJ/mol
H = -a kJ/mol
2H2(g) + O2(g) = 2H2O(1) ![]() H = -b kJ/mol
H = -b kJ/mol
写出上述固氮反应的热化学方程式:_______________。
(2)恒温、恒容条件下,在容器中模拟Haber-Bosch法合成氨,如下图(图中所示数据为初始物理量)。t分钟后反应达到平衡,生成的NH3为0.4 mol。
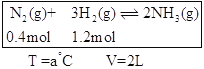
①判断该容器中的反应达平衡的依据是_______(填字母)。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(N2)不随时间改变
d.单位时间内生成2 mol NH3的同时消耗1 mol N2
e.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下容器中反应的平衡常数K=___;平衡时,混合气体压强p平=____(用初始压强p0表示)。
(3)近期,两位希腊化学家提出了电解合成氨的新思路:采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如图:
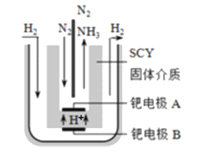
钯电极A是电解池的_____极(填“阳”或“阴”),阴极反应式为________________________________。
(4)合成氨需要纯净的氮气和氢气,在制取原料气的过程中,常混有一些杂质,其中的某些杂质会使合成氨的催化剂“中毒”,所以必须除去。例如,用稀氨水吸收H2S杂质:NH3·H2O + H2S![]()
![]() +HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
+HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
【答案】2N2(g)+6H2O(l) = 4NH3(g) + 3O2(g) ![]() H= (3b-2a) kJ/mol ace
H= (3b-2a) kJ/mol ace ![]() (或14.8)
(或14.8) ![]() P0 阴 N2 + 6e- + 6H+ = 2NH3 91
P0 阴 N2 + 6e- + 6H+ = 2NH3 91
【解析】
(1)根据盖斯定律分析解答;
(2)①根据可逆反应到达平衡时,正、逆速率相等,各组分的浓度、含量保持不变分析判断;②根据三段式列式计算;
(3)电解池中,阳离子移向阴极,在阴极上发生还原反应;
(4)首先计算NH3·H2O + H2S![]()
![]() +HS-+ H2O的平衡常数,再假设反应的H2S为物质的量浓度为x,根据平衡常数列式计算。
+HS-+ H2O的平衡常数,再假设反应的H2S为物质的量浓度为x,根据平衡常数列式计算。
(1)①N2(g)+3H2(g)=2NH3(g) △H=-a kJ/mol,②O2(g)+2H2(g)═2H2O(l) △H=-b kJ/mol,根据盖斯定律,将①×2-②×3得到反应2N2(g)+6H2O(l)═4NH3(g)+3O2(g)△H=(3b-2a)kJ/mol,故答案为:2N2(g)+6H2O(I)=4NH3(g)+3O2(g)△H=(3b-2a)kJ/mol;
(2)①a.该反应反应后气体物质的量减小,恒温恒容下容器内压强减小,当压强不随时间改变,说明到达平衡状态,故a正确;b.混合气体总质量不变,容器容积不变,混合气体的密度始终不变,混合气体的密度不变,不能说明到达平衡状态,故b错误;c.到达平衡时各组分浓度保持不变,c(N2)不随时间改变,说明到达化学平衡状态,故c正确;d.单位时间内生成2molNH3的同时消耗1molN2,均表示正反应速率,反应始终按该比例关系进行,不能说明到达平衡状态,故d错误;e.单位时间内断裂3molH-H键,同时断裂6molN-H键,而断裂6molN-H键会生成3molH-H键,氢气的生成速率与消耗速率相等,说明反应到达平衡,故e正确,故选:ace;
②甲容器t分钟后反应均达到平衡,生成的NH3均为0.4mol,则:
N2(g)+3H2(g)2NH3(g)
起始量(mol):0.4 1.2 0
变化量(mol):0.2 0.6 0.4
平衡量(mol):0.2 0.6 0.4
则平衡常数K=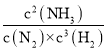 =
=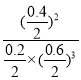 =
=![]() ;恒温恒容下压强之比等于气体物质的量之比,则平衡时,甲的压强P平=
;恒温恒容下压强之比等于气体物质的量之比,则平衡时,甲的压强P平=![]() P0=
P0=![]() P0,故答案为:
P0,故答案为:![]() ;
;![]() P0;
P0;
(3)电解池中,氢离子移向阴极,所以钯电极A是电解池的阴极,阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,即N2+6e-+6H+=2NH3,阳极反应式为:H2-2e-=2H+,故答案为:阴;N2+6e-+6H+=2NH3;
(4)标况下22.4L H2S的物质的量=![]() =1mol,1L 1mol/L NH3·H2O中含有1molNH3·H2O,NH3·H2O + H2S
=1mol,1L 1mol/L NH3·H2O中含有1molNH3·H2O,NH3·H2O + H2S![]()
![]() +HS-+ H2O的平衡常数K=
+HS-+ H2O的平衡常数K=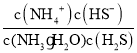 =
=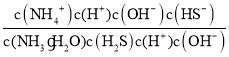 =
=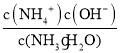 ×
×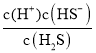 ×
×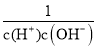 =Kb×Ka1×
=Kb×Ka1×![]() =2×10-5×5×10-8×
=2×10-5×5×10-8×![]() =100,设反应的H2S为物质的量浓度为x,因此100=
=100,设反应的H2S为物质的量浓度为x,因此100=![]() ,解得x=
,解得x=![]() mol/L,则吸收效率=
mol/L,则吸收效率= ×100%=
×100%=![]() ×100%=91%,故答案为:91。
×100%=91%,故答案为:91。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法符合事实的是
A.强酸与强碱中和滴定时可以选用甲基橙或酚酞作指示剂;强碱与弱酸中和滴定时应该选用酚酞作指示剂
B.在5![]() 的
的![]() 溶液中加入3mL等浓度的NaCl溶液,有白色沉淀产生,再加入3mL等浓度的
溶液中加入3mL等浓度的NaCl溶液,有白色沉淀产生,再加入3mL等浓度的![]() 溶液,溶液中又有黑色沉淀生成,说明
溶液,溶液中又有黑色沉淀生成,说明![]()
C.物质的量浓度均为![]() 的弱酸HX及其盐NaX溶液等体积混合后:
的弱酸HX及其盐NaX溶液等体积混合后:![]()
![]()
D.已知![]() ,
,![]() 。在含
。在含![]() 、
、![]() 浓度相同的溶液中滴加
浓度相同的溶液中滴加![]() 溶液时,首先生成
溶液时,首先生成![]() 沉淀
沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的离子浓度关系式正确的是
A.pH =2的H2C2O4(二元弱酸)溶液与pH=12的NaOH溶液任意比例混合:c(Na+) + c(H+)= c(OH-) + c(![]() )
)
B.pH = a的氨水溶液中,c(NH3·H2O) = 10-a mol/L
C.新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
D.pH相同的①CH3COONa,②NaHCO3,③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜, 主要作用是在反应过程中只让Li+通过。结构如图所示。
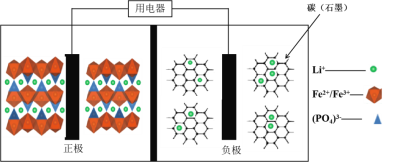
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A. 放电时,正极电极反应式:xFePO4+xLi++xe-===xLiFePO4
B. 放电时,电子由负极经导线、用电器、导线到正极
C. 充电时,阴极电极反应式:xLi++xe-+nC===LixCn
D. 充电时,Li+向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸(HCOOH)是一种常见的一元弱酸,在水溶液中存在如下电离平衡:HCOOH![]() H++HCOO-,下列有关说法不正确的是
H++HCOO-,下列有关说法不正确的是
A.在该溶液中,c(H+)略大于c(HCOO-)
B.向该溶液中加入NaOH固体,电离平衡正向移动,pH值增大
C.将氯化氢气体通入溶液中,平衡逆向移动,c(HCOO-)增大
D.将溶液加水稀释,c(OH-)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:
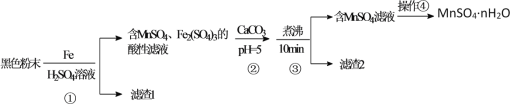
下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式正确的是( )
A.稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.向Ca(
HCO3)
2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.碳酸氢钠溶液水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )
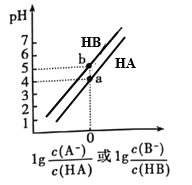
A. a点时,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1
B. 电离平衡常数:Ka(HA)< Ka(HB)
C. b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D. 向HB溶液中滴加NaOH溶液至pH=7时:c(B-)> c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
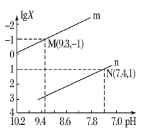
A.曲线m表示pH与lg![]() 的变化关系
的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-7.4
D.25℃时,CO32-+H2OHCO3-+OH-的水解常数为1.0×10-3.7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com