
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
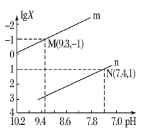
A.曲线m表示pH与lg![]() 的变化关系
的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-7.4
D.25℃时,CO32-+H2OHCO3-+OH-的水解常数为1.0×10-3.7
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氨是最重要的化工原料之一,自20世纪初以来,工业上合成氨主要依赖Haber-Bosch技术。探索新的合成氨的方法一直是重要课题。
(1)最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气。
已知:N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g) ![]() H = -a kJ/mol
H = -a kJ/mol
2H2(g) + O2(g) = 2H2O(1) ![]() H = -b kJ/mol
H = -b kJ/mol
写出上述固氮反应的热化学方程式:_______________。
(2)恒温、恒容条件下,在容器中模拟Haber-Bosch法合成氨,如下图(图中所示数据为初始物理量)。t分钟后反应达到平衡,生成的NH3为0.4 mol。
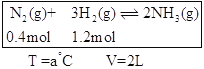
①判断该容器中的反应达平衡的依据是_______(填字母)。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(N2)不随时间改变
d.单位时间内生成2 mol NH3的同时消耗1 mol N2
e.单位时间内断裂3 mol H-H键,同时断裂6 mol N-H键
②该条件下容器中反应的平衡常数K=___;平衡时,混合气体压强p平=____(用初始压强p0表示)。
(3)近期,两位希腊化学家提出了电解合成氨的新思路:采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如图:
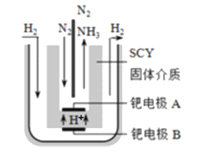
钯电极A是电解池的_____极(填“阳”或“阴”),阴极反应式为________________________________。
(4)合成氨需要纯净的氮气和氢气,在制取原料气的过程中,常混有一些杂质,其中的某些杂质会使合成氨的催化剂“中毒”,所以必须除去。例如,用稀氨水吸收H2S杂质:NH3·H2O + H2S![]()
![]() +HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
+HS-+ H2O,若将标况下22.4L H2S通入1L 1mol/L NH3·H2O中进行吸收,则达到平衡时,H2S的吸收效率为_________%(结果保留两位有效数字)。(注:吸收效率=c(H2S)已反应/c(H2S)总)(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2S的电离平衡常数Ka1 = 5×10-8,Ka2 = 7.1×10-15)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学们通过以下实验探究乙醇的化学性质。

(1)乙醇的官能团是___(写名称)。
(2)实验Ⅰ中观察到的现象是___,有关反应的化学方程式是___。
(3)向实验Ⅱ的A试管内加入药品的先后顺序是___,加热后A试管内发生反应的化学方程式是___,该反应的类型是___。
(4)实验Ⅱ的B试管中盛放的液体是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 电解精炼铜,当外电路通过NA个电子时;阳极质量减少32 g
B. 反应3H2(g)+N2(g) ![]() 2NH3(g) △H=-92kJ·mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA
2NH3(g) △H=-92kJ·mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA
C. lmol·L-1的氯化铜溶液中,若Cl-的数目为2Na,则Cu2+的数目为Na
D. 标准状况下,NO和O2各11. 2L混合充分反应,所得气体的分子总数为0.75 Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示反应2SO2(g)+O2(g)![]() 2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
2SO3(g)H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是( )
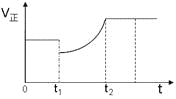
A.t1时减小了SO2的浓度,增加了SO3的浓度
B.t1时降低了温度,平衡向正反应方向移动
C.t1时减小了压强,平衡向逆反应方向移动
D.t1时增加了SO2和O2的浓度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大
B.常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b
C.若将适量CO2通入0.1molL-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1molL-1
D.常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:KaKh=Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是

A. 电流由O2所在的铂电极经外电路流向另一电极
B. O2所在的铂电极处发生还原反应
C. 该电池的负极反应式为:CH3CH2OH+3H2O-12e-="=" 2CO2↑+12H+
D. 微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.常温下,某溶液中由水电离出的![]() ,若
,若![]() ,则该溶液的
,则该溶液的![]()
B.常温下,某醋酸稀溶液![]() ,将此溶液稀释100倍后溶液的
,将此溶液稀释100倍后溶液的![]() ,则
,则![]()
C.等浓度的醋酸钠和盐酸按体积比2:1混合,则![]()
D.已知![]() 的
的![]() 为
为![]() ,则将等体积的
,则将等体积的![]() 的
的![]() 溶液和
溶液和![]() 溶液混合,会有
溶液混合,会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应为:2SO2(g)+O2(g) ![]() 2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
A.反应在前2 s的平均速率υ(O2)=0.4 mol·L1·s1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2) 增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com