
【题目】某兴趣小组的同学们通过以下实验探究乙醇的化学性质。

(1)乙醇的官能团是___(写名称)。
(2)实验Ⅰ中观察到的现象是___,有关反应的化学方程式是___。
(3)向实验Ⅱ的A试管内加入药品的先后顺序是___,加热后A试管内发生反应的化学方程式是___,该反应的类型是___。
(4)实验Ⅱ的B试管中盛放的液体是___。
【答案】羟基 钠沉在乙醇底部,产生少量气泡 2Na+2CH3CH2OH→2CH3CH2ONa+H2↑ 乙醇、浓硫酸、乙酸 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 酯化反应 饱和Na2CO3溶液
CH3COOC2H5+H2O 酯化反应 饱和Na2CO3溶液
【解析】
(1)乙醇的结构简式为CH3CH2OH,官能团为:-OH,名称是羟基;
(2)实验Ⅰ中钠与乙醇反应生成氢气,由于钠的密度大于乙醇,所以观察到的现象是钠沉在乙醇底部,产生少量气泡;有关反应的化学方程式是2Na+2CH3CH2OH→2CH3CH2ONa+H2↑;
(3) 一般把密度大的液体加入到密度小的液体中,浓硫酸溶于水放出大量的热,且浓硫酸密度大于乙醇,所以应该先加乙醇,然后缓缓加入浓硫酸,同时用玻璃棒不断搅拌,冷却后加入乙酸,所以加入药品的先后顺序是乙醇、浓硫酸、乙酸;加热后A试管内发生酯化反应,生成乙酸乙酯,反应的化学方程式是CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;该反应的类型是酯化反应;
CH3COOC2H5+H2O;该反应的类型是酯化反应;
(4)实验Ⅱ的B试管中盛放的液体是饱和Na2CO3溶液,用来吸收乙醇、除去乙酸、降低乙酸乙酯在水中的溶解度。


科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的离子浓度关系式正确的是
A.pH =2的H2C2O4(二元弱酸)溶液与pH=12的NaOH溶液任意比例混合:c(Na+) + c(H+)= c(OH-) + c(![]() )
)
B.pH = a的氨水溶液中,c(NH3·H2O) = 10-a mol/L
C.新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
D.pH相同的①CH3COONa,②NaHCO3,③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式正确的是( )
A.稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.向Ca(
HCO3)
2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.碳酸氢钠溶液水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )
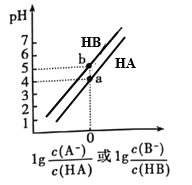
A. a点时,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1
B. 电离平衡常数:Ka(HA)< Ka(HB)
C. b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D. 向HB溶液中滴加NaOH溶液至pH=7时:c(B-)> c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃条件下,用0.1molL-1的一元弱酸HR[已知:25℃时,Ka(HR)=1.7×10-5]溶液滴定10.00mL0.1molL-1一元碱MOH溶液,滴定过程中HR溶液的体积与溶液中lg![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )

A.25℃时,0.1molL-1的MOH溶液pH<13
B.a点消耗HR溶液的体积等于10.00mL
C.b点溶液中c(R-)>c(H+)>c(M+)>c(OH-)
D.25℃时,MR溶液中![]() =
=![]() ×10-9
×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下某容器中各微粒在反应前后的变化如图所示,其中●和代表不同元素的原子。关于此反应说法错误的是

A.一定属于化合反应
B.一定属于可逆反应
C.一定属于吸热反应
D.一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
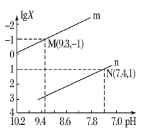
A.曲线m表示pH与lg![]() 的变化关系
的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-7.4
D.25℃时,CO32-+H2OHCO3-+OH-的水解常数为1.0×10-3.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。试回答:
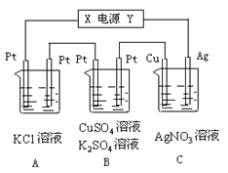
(1)电源电极X名称为_________(填“正极”或“负极”)
(2)烧杯中溶液的 pH变化:(填“增大”、“减小”或“不变”)B池________________,C池________________。
(3)写出A池中所发生的电解反应方程式:_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com