
【题目】25℃条件下,用0.1molL-1的一元弱酸HR[已知:25℃时,Ka(HR)=1.7×10-5]溶液滴定10.00mL0.1molL-1一元碱MOH溶液,滴定过程中HR溶液的体积与溶液中lg![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )

A.25℃时,0.1molL-1的MOH溶液pH<13
B.a点消耗HR溶液的体积等于10.00mL
C.b点溶液中c(R-)>c(H+)>c(M+)>c(OH-)
D.25℃时,MR溶液中![]() =
=![]() ×10-9
×10-9
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
【题目】运用有关概念,判断下列叙述正确的是![]()
A.![]() 溶于水后能导电,故C
溶于水后能导电,故C![]() 为电解质
为电解质
B.![]() 、
、![]() 、
、![]() 、
、![]() 互为同素异形体
互为同素异形体
C.NaCl溶液和![]() 溶液均显中性,故两溶液中水的电离程度相同
溶液均显中性,故两溶液中水的电离程度相同
D.溶液与胶体本质区别为分散质微粒直径的大小不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Mg(OH)2(s) ![]() MgCl2(aq)
MgCl2(aq) ![]() Mg(s)
Mg(s)
B.FeCl2(aq) ![]() FeCl3(aq)
FeCl3(aq) ![]() Fe(OH)3(胶体)
Fe(OH)3(胶体)
C.AgNO3(aq) ![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq) ![]() Ag(s)
Ag(s)
D.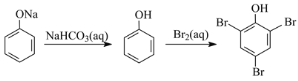
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是巨大的化学资源宝库,人类每年都会从海水中提取很多物质,如图是海水资源综合利用的部分流程。
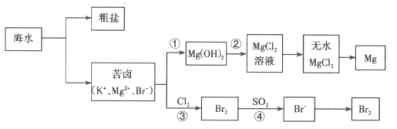
请回答下列问题:
(1)从海水中获取粗盐的方法是___。
(2)步骤①中所加试剂是___,步骤②中发生反应的离子方程式是___。
(3)步骤③中发生反应的离子方程式是___。
(4)步骤④中用“热空气”能从溶液中将Br2吹出的原因是___,用SO2水溶液吸收吹出的Br2时,反应过程中的氧化剂是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学们通过以下实验探究乙醇的化学性质。

(1)乙醇的官能团是___(写名称)。
(2)实验Ⅰ中观察到的现象是___,有关反应的化学方程式是___。
(3)向实验Ⅱ的A试管内加入药品的先后顺序是___,加热后A试管内发生反应的化学方程式是___,该反应的类型是___。
(4)实验Ⅱ的B试管中盛放的液体是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 电解精炼铜,当外电路通过NA个电子时;阳极质量减少32 g
B. 反应3H2(g)+N2(g) ![]() 2NH3(g) △H=-92kJ·mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA
2NH3(g) △H=-92kJ·mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA
C. lmol·L-1的氯化铜溶液中,若Cl-的数目为2Na,则Cu2+的数目为Na
D. 标准状况下,NO和O2各11. 2L混合充分反应,所得气体的分子总数为0.75 Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大
B.常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b
C.若将适量CO2通入0.1molL-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1molL-1
D.常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:KaKh=Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是( )
A.常温下,![]() 的
的![]() 与
与![]() 混合溶液中:
混合溶液中:![]()
B.NaCl溶液和![]() 溶液均显中性,两溶液中水的电离程度相同
溶液均显中性,两溶液中水的电离程度相同
C.相同温度下,若![]() ,则AgCl的溶解度大于
,则AgCl的溶解度大于![]()
D.醋酸溶液加少量水稀释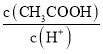 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com