
【题目】下列叙述正确的是( )
A.常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大
B.常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b
C.若将适量CO2通入0.1molL-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1molL-1
D.常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:KaKh=Kw
【答案】D
【解析】
A.![]() 、
、![]() 都抑制AgCl溶解,常温下,物质的量浓度相同的硝酸银和氯化钠溶液其抑制AgCl溶解程度相等,所以AgCl在同物质的量浓度的
都抑制AgCl溶解,常温下,物质的量浓度相同的硝酸银和氯化钠溶液其抑制AgCl溶解程度相等,所以AgCl在同物质的量浓度的![]() 和NaCl溶液中的溶解度相同,故A错误;
和NaCl溶液中的溶解度相同,故A错误;
B.常温下![]() 的醋酸浓度大于
的醋酸浓度大于![]() 的NaOH浓度,二者等体积混合后溶液中溶质为醋酸和醋酸钠,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性;等物质的量浓度的HCl和NaOH溶液等体积混合,二者恰好完全反应生成NaCl,溶液呈中性,酸或碱抑制水电离,所以前者抑制水电离,则水的电离程度:
的NaOH浓度,二者等体积混合后溶液中溶质为醋酸和醋酸钠,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性;等物质的量浓度的HCl和NaOH溶液等体积混合,二者恰好完全反应生成NaCl,溶液呈中性,酸或碱抑制水电离,所以前者抑制水电离,则水的电离程度:![]() ,故B错误;
,故B错误;
C.若将适量![]() 通入
通入![]()
![]() 溶液中至溶液恰好呈中性,则存在
溶液中至溶液恰好呈中性,则存在![]() ,溶液中存在电荷守恒
,溶液中存在电荷守恒![]() ,则
,则![]() ,故C错误;
,故C错误;
D.常温下,醋酸电离平衡常数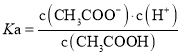 、醋酸根水解平衡常数
、醋酸根水解平衡常数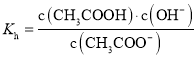 ,离子积常数
,离子积常数![]() ,则
,则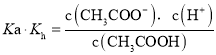
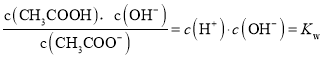 ,故D正确;
,故D正确;
答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一种利用废干电池中黑色粉末(主要成分MnO2、炭粉及少量Hg2+、Pb2+等重金属盐)制备MnSO4晶体的工艺流程如图:
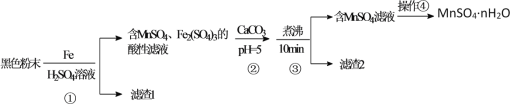
下列说法错误的是( )
A.反应①中1molFe至多还原1.5molMnO2
B.重金属主要在滤渣2中
C.步骤③煮沸可使沉淀颗粒长大,目的是便于固液分离
D.合理处理废旧电池有利于资源再利用并防止汞、铅等重金属污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃条件下,用0.1molL-1的一元弱酸HR[已知:25℃时,Ka(HR)=1.7×10-5]溶液滴定10.00mL0.1molL-1一元碱MOH溶液,滴定过程中HR溶液的体积与溶液中lg![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )

A.25℃时,0.1molL-1的MOH溶液pH<13
B.a点消耗HR溶液的体积等于10.00mL
C.b点溶液中c(R-)>c(H+)>c(M+)>c(OH-)
D.25℃时,MR溶液中![]() =
=![]() ×10-9
×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电离常数的负对数pK=-lgK,25℃时,HX的pKa=4.76,H2Y的pKa1=1.22,pKa2=4.19,下列说法正确的是( )
A.浓度相等的NH4X和NH4HY溶液中c(NH4+):前者大于后者
B.NaX溶液中滴加KHY溶液至pH=4.76:c(K+)+c(Na+)>c(HY-)+2c(Y2-)+c(X-)
C.KHY溶液中滴加氨水至中性:c(NH4+)>c(Y2-)
D.K2Y溶液中滴加盐酸至pH=1.22:c(Cl-)-3c(HY-)=c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
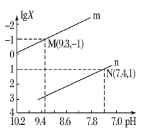
A.曲线m表示pH与lg![]() 的变化关系
的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-7.4
D.25℃时,CO32-+H2OHCO3-+OH-的水解常数为1.0×10-3.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在指定的环境下可以大量共存的是( )
A.在pH=0的溶液中:Na+、Fe2+、Cl-、![]()
B.由水电离出的c(H+)=1×10-14mol/L的溶液:K+、![]() 、Cl-、
、Cl-、![]()
C.c(H+)<c(OH-)溶液:Na+、K+、![]() 、
、![]()
D.PH=2的一元酸和PH=12的一元强碱等体积混合:c(OH-)=C(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
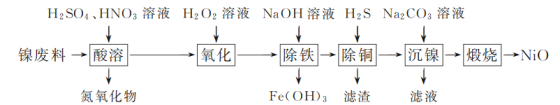
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组利用压强传感器、数据采集器和计算机等数字化实验设备,探究用0.01g镁条分别与2mL不同浓度稀盐酸的反应速率。实验结果如图所示。
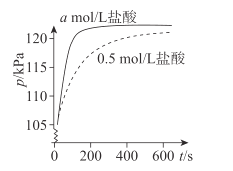
(1)Mg与盐酸反应的离子方程式是________。
(2)从微粒角度分析,该实验是为了探究________(因素)对该反应的化学反应速率的影响。
(3)a________0.5(填“>”或“<”)。
(4)如果用0.5mol/L硫酸代替上述实验中的0.5mol/L盐酸,二者的反应速率是否相同____,请说明原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BeTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__。
(2)用盐酸酸浸时发生反应的离子方程式为:__,为提高酸浸速率,可适当进行加热,但温度不宜过高,原因是__。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有:__。
②简述证明草酸氧化钛钡晶体已洗净的操作及现象__。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:__。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.05mol/L,则c(CO32-)在浸出液中的最大浓度为__mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com