
【题目】下列有关叙述中正确的是( )
A.常温下,![]() 的
的![]() 与
与![]() 混合溶液中:
混合溶液中:![]()
B.NaCl溶液和![]() 溶液均显中性,两溶液中水的电离程度相同
溶液均显中性,两溶液中水的电离程度相同
C.相同温度下,若![]() ,则AgCl的溶解度大于
,则AgCl的溶解度大于![]()
D.醋酸溶液加少量水稀释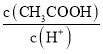 增大
增大
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】25℃条件下,用0.1molL-1的一元弱酸HR[已知:25℃时,Ka(HR)=1.7×10-5]溶液滴定10.00mL0.1molL-1一元碱MOH溶液,滴定过程中HR溶液的体积与溶液中lg![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )

A.25℃时,0.1molL-1的MOH溶液pH<13
B.a点消耗HR溶液的体积等于10.00mL
C.b点溶液中c(R-)>c(H+)>c(M+)>c(OH-)
D.25℃时,MR溶液中![]() =
=![]() ×10-9
×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
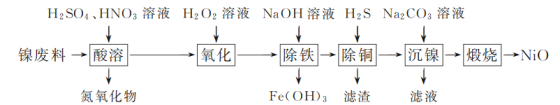
【题目】某课外实验小组利用压强传感器、数据采集器和计算机等数字化实验设备,探究用0.01g镁条分别与2mL不同浓度稀盐酸的反应速率。实验结果如图所示。
(1)Mg与盐酸反应的离子方程式是________。
(2)从微粒角度分析,该实验是为了探究________(因素)对该反应的化学反应速率的影响。
(3)a________0.5(填“>”或“<”)。
(4)如果用0.5mol/L硫酸代替上述实验中的0.5mol/L盐酸,二者的反应速率是否相同____,请说明原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
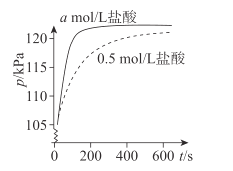
【题目】如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。试回答:
(1)电源电极X名称为_________(填“正极”或“负极”)
(2)烧杯中溶液的 pH变化:(填“增大”、“减小”或“不变”)B池________________,C池________________。
(3)写出A池中所发生的电解反应方程式:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
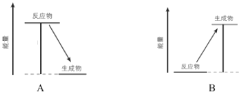
【题目】化学反应中不仅有物质变化而且伴随着能量变化。
(1)以下实验中属于吸热反应的是________(填序号)。

(2)下图中,表示放热反应能量变化的是_______(填字母)。
(3)从微观角度分析化学反应中能量变化的原因:
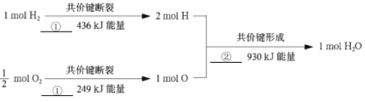
图中①和②分别为_______、_______(填“吸收”或“释放”)。氢气与氧气反应生成1mol水蒸气时,释放________kJ能量。
(4)当前,很多地区倡导用天然气替代煤作为家用燃料,根据下表从尽可能多的角度分析其原因是__。
燃料 | 燃烧释放的能量(每1千克) |
天然气 | 55812kJ |
煤 | 20908kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CH3COONa溶液里,加入下列物质使水解平衡向左移动,并且pH变大的是 ( )
A. 加入适量纯CH3COOH
B. 加入少量NaCl固体
C. 加入少量NaOH固体
D. 加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BeTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:

已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__。
(2)用盐酸酸浸时发生反应的离子方程式为:__,为提高酸浸速率,可适当进行加热,但温度不宜过高,原因是__。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有:__。
②简述证明草酸氧化钛钡晶体已洗净的操作及现象__。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:__。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:___。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.05mol/L,则c(CO32-)在浸出液中的最大浓度为__mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,将
时,将![]() 的盐酸与b
的盐酸与b![]() 的氨水等体积混合,反应后溶液呈中性
的氨水等体积混合,反应后溶液呈中性![]() 忽略溶液混合后体积的变化
忽略溶液混合后体积的变化![]() 下列说法不正确的是
下列说法不正确的是![]()
A.此时水的电离程度并不是最大
B.混合溶液中的离子浓度:![]()
C.此时溶液中![]() 的浓度为
的浓度为![]()
D.用含b的代数式不能表示![]() 时
时![]() 的电离常数
的电离常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com